早教吧作业答案频道 -->化学-->
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料.现有废铜(主要杂质为Fe)来制备胆矾.有人设计了如下流程:pH值控制可参考下列数据物质开始沉淀时的p
题目详情
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料.现有废铜(主要杂质为Fe)来制备胆矾.有人设计了如下流程:
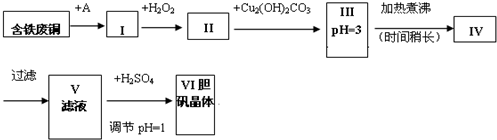
pH值控制可参考下列数据
请根据上述流程回答下列问题:
(1)A物质可选用___(填字母).
a.稀H2SO4b.浓H2SO4/△c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的___.
(3)Ⅱ中加Cu2(OH)2CO3的目的是___;其优点是___.
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为___.
(5)V中加H2SO4调节pH=1是为了___.
(6)V到Ⅵ的操作是___
(7)某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是___.如何改进___.

pH值控制可参考下列数据
| 物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
(1)A物质可选用___(填字母).
a.稀H2SO4b.浓H2SO4/△c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的___.
(3)Ⅱ中加Cu2(OH)2CO3的目的是___;其优点是___.
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为___.
(5)V中加H2SO4调节pH=1是为了___.
(6)V到Ⅵ的操作是___
(7)某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是___.如何改进___.
▼优质解答
答案和解析
废铜(主要杂质为Fe)来制备胆矾的流程:将金属全部溶解,再将存在的亚铁离子氧化为铁离子,再结合Cu2+开始沉淀时的pH值,可以Fe最终转化为Fe(OH)3更容易除去,保证铜离子不会沉淀,不能引进杂质离子,加入H2O2,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3.当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有SO42-,再加硫酸,调节溶液pH值=1,目的是抑制Cu2+的水解,再分别进行蒸发、冷却、结晶后,最终得到产品胆矾.
(1)A可选用浓H2SO4、加热,稀硫酸不能溶解Cu,而浓FeCl3溶液、浓HNO3会引入杂质,
故答案为:b;
(2)H2O2与Fe2+发生氧化还原反应,Fe2+被氧化为Fe3+后,调节pH,更容易除去,所以Ⅰ中加H2O2的目的将亚铁离子氧化为铁离子,
故答案为:将Fe2+氧化为Fe3+;
(3)在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3,并且不引入新的杂质,
故答案为:中和过量的硫酸,调节溶液的pH,使Fe3+水解完全而沉淀;不引入新的杂质;
(4)Ⅲ加热煮沸时,促进铁离子水解,可以得到氢氧化铁沉淀,发生的化学反应的离子方程式为:Fe3++3H2O
Fe(OH)3↓+3H+,
故答案为:Fe3++3H2O
Fe(OH)3↓+3H+;
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解,
故答案为:抑制Cu2+的水解;
(6)从硫酸铜溶液中获得硫酸铜晶体可以经过蒸发浓缩,冷却结晶,过滤的方法,
故答案为:蒸发浓缩,冷却结晶,过滤;
(7)Cu与浓硫酸反应过程中会产生SO2,会对污染环境,这样会使硫酸的利用率低,所以可以向稀硫酸中不断通氧气(或者加H2O2)并加热,
故答案为:会产生SO2,会对污染环境,硫酸的利用率低;可以向稀硫酸中不断通氧气(或者加H2O2)并加热.
(1)A可选用浓H2SO4、加热,稀硫酸不能溶解Cu,而浓FeCl3溶液、浓HNO3会引入杂质,
故答案为:b;
(2)H2O2与Fe2+发生氧化还原反应,Fe2+被氧化为Fe3+后,调节pH,更容易除去,所以Ⅰ中加H2O2的目的将亚铁离子氧化为铁离子,
故答案为:将Fe2+氧化为Fe3+;
(3)在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3,并且不引入新的杂质,
故答案为:中和过量的硫酸,调节溶液的pH,使Fe3+水解完全而沉淀;不引入新的杂质;
(4)Ⅲ加热煮沸时,促进铁离子水解,可以得到氢氧化铁沉淀,发生的化学反应的离子方程式为:Fe3++3H2O
| ||
故答案为:Fe3++3H2O
| ||
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解,
故答案为:抑制Cu2+的水解;
(6)从硫酸铜溶液中获得硫酸铜晶体可以经过蒸发浓缩,冷却结晶,过滤的方法,
故答案为:蒸发浓缩,冷却结晶,过滤;
(7)Cu与浓硫酸反应过程中会产生SO2,会对污染环境,这样会使硫酸的利用率低,所以可以向稀硫酸中不断通氧气(或者加H2O2)并加热,
故答案为:会产生SO2,会对污染环境,硫酸的利用率低;可以向稀硫酸中不断通氧气(或者加H2O2)并加热.
看了 胆矾是一种常见的化合物,工业...的网友还看了以下:
关于单原子分子与原子,单元子分子是分子还是原子为什么题目答案上说白磷和硫是分子构成,铜是原子 2020-05-13 …
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题(I)以 2020-05-17 …
冶炼金属铜产生的氧化铜怎么还原成金属铜怎么能一下在还原很多.大概有5吨左右.而且氧化铜里还含有很多 2020-07-14 …
已知铜的密度是8.9x10^3kg/m^3,铜的摩尔质量是63.5x10^-3kg/mol1求一个铜 2020-10-31 …
安徽省铜产量占全国铜总产量的10%以上,火法炼铜的原理为:Cu2S+O2高温.2Cu+SO2,计算: 2020-11-10 …
某活动小组用废铜制取硫酸铜溶液,实验过程为:(1)废铜在空气中加热后得到的氧化铜中含有少量铜,原因是 2021-02-01 …
某活动小组用废铜制取硫酸铜溶液,实验过程为:⑴废铜在空气中加热后得到的氧化铜中含有少量铜,原因是(填 2021-02-01 …
(2009•安徽)某活动小组用废铜制取硫酸铜溶液,实验过程为:(1)废铜在空气中加热后得到的氧化铜中 2021-02-01 …
(5分)某活动小组用废铜制取硫酸铜溶液,实验过程为:⑴废铜在空气中加热后得到的氧化铜中含有少量铜, 2021-02-01 …
某活动小组用废铜制取硫酸铜溶液,实验过程为:(1)废铜在空气中加热后得到的氧化铜中含有少量铜,原因是 2021-02-01 …