早教吧作业答案频道 -->化学-->
氢气是一种清洁能源.制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题.(1)用甲烷制取氢气的两步反应的能量变化如1图所示:①甲烷和水蒸气反应生成二氧化碳
题目详情
氢气是一种清洁能源.制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题.
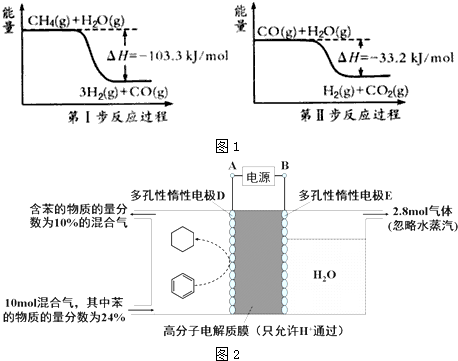
(1)用甲烷制取氢气的两步反应的能量变化如1图所示:
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是___.
②第Ⅱ步反应为可逆反应.800℃时,若CO的起始浓度为2.0mol•L-1,水蒸气的起始浓度为3.0mol•L-1,达到化学平衡状态后,测得CO2的浓度为1.2mol•L-1,则CO的平衡转化率为___.
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为___,反应消耗1mol NaBH4时转移的电子数目为___.
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢.
 +3H2(g)
+3H2(g)
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol•L-1,平衡时苯的浓度为b mol•L-1,该反应的平衡常数K=___(用含a、b的关系式表达).
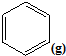
(4)一定条件下,如2图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成).
①实现有机物储氢的电极是___;
A.正极 B.负极 C.阴极 D.阳极
其电极反应方程为:___.
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是___.由表中数据可知,此装置的电流效率η=___.[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位].

(1)用甲烷制取氢气的两步反应的能量变化如1图所示:
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是___.
②第Ⅱ步反应为可逆反应.800℃时,若CO的起始浓度为2.0mol•L-1,水蒸气的起始浓度为3.0mol•L-1,达到化学平衡状态后,测得CO2的浓度为1.2mol•L-1,则CO的平衡转化率为___.
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为___,反应消耗1mol NaBH4时转移的电子数目为___.
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢.

| FeSO4/Al2O3 |
| |
| 高温 |
 +3H2(g)
+3H2(g)在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol•L-1,平衡时苯的浓度为b mol•L-1,该反应的平衡常数K=___(用含a、b的关系式表达).
(4)一定条件下,如2图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成).
①实现有机物储氢的电极是___;
A.正极 B.负极 C.阴极 D.阳极
其电极反应方程为:___.
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是___.由表中数据可知,此装置的电流效率η=___.[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位].
▼优质解答
答案和解析
(1)①根据第一步反应过程可以得出:CH4(g)+H2O(g)=3H2(g)+CO(g),△H=-103.3KJ/mol;
根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2KJ/mol;
根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol,故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol;
②设CO的平衡转化量为x,
CO(g)+H2O(g)=H2(g)+CO2(g)
初始浓度:2.0 3.0 0 0
变化浓度:1.2 1.2 1.2 1.2
平衡浓度:0.8 1.8 1.2 1.2
则CO的平衡转化率为
×100%=60%,故答案为:60%;
(2)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,NaBO2中B元素化合价为+3价,所以NaBH4中H元素的化合价为-1价,所以H元素化合价由-1价、+1价变为0价,再结合转移电子守恒配平方程式为NaBH4+2H2O=NaBO2+4H2↑,反应消耗1mol NaBH4时转移的物质的量=1mol×4×(1-0)=4mol,所以转移电子数为4NA或2.408×1024,故答案为:NaBH4+2H2O=NaBO2+4H2↑;4NA或2.408×1024;
(3)环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=
mol3•L-3=
=
mol3•L-3,
故答案为:
mol3•L-3;
(4)①活泼的氢发生氧化反应,是负极,该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C;C6H6+6H++6e-=C6H12;
②阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,
生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量=
=10%,
x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则
×100%=64.3%,
故答案为:H2,64.3%.
根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2KJ/mol;
根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol,故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol;
②设CO的平衡转化量为x,
CO(g)+H2O(g)=H2(g)+CO2(g)
初始浓度:2.0 3.0 0 0
变化浓度:1.2 1.2 1.2 1.2
平衡浓度:0.8 1.8 1.2 1.2
则CO的平衡转化率为
| 1.2mol/L |
| 2.0mol/L |
(2)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,NaBO2中B元素化合价为+3价,所以NaBH4中H元素的化合价为-1价,所以H元素化合价由-1价、+1价变为0价,再结合转移电子守恒配平方程式为NaBH4+2H2O=NaBO2+4H2↑,反应消耗1mol NaBH4时转移的物质的量=1mol×4×(1-0)=4mol,所以转移电子数为4NA或2.408×1024,故答案为:NaBH4+2H2O=NaBO2+4H2↑;4NA或2.408×1024;
(3)环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=
| c(C6H6).c3(H2) |
| c(C6H12) |
| b×(3b)3 |
| (a-b) |
| 27b4 |
| a-b |
故答案为:
| 27b4 |
| a-b |
(4)①活泼的氢发生氧化反应,是负极,该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C;C6H6+6H++6e-=C6H12;
②阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,
生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量=
| 10mol×24%-x |
| 10mol-3xmol+5.6mol |
x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则
| 7.2mol |
| 11.2mol |
故答案为:H2,64.3%.
看了 氢气是一种清洁能源.制氢和储...的网友还看了以下:
人造奶油(也就是植物奶油)是不是高级脂肪酸还是甘油?写出油脂氢化的化学方程式生成什么物质? 2020-05-15 …
油脂A的通式为(烃基R中不含有叁键).0.1mol的A与溶有96g液Br2的四氯化碳恰好完全反应. 2020-05-16 …
氢化钙与水的反应?氢化钙中氢为-1价 CaH2+2H2O=Ca(OH)2+2H2↑水的作用是?还原 2020-05-17 …
在由粗硅制纯硅的反应中氯气与硅的反应属于什么类型的反应?氢气的作用是什么? 2020-06-21 …
一节干电池,在使用了一段时间后电动势会变小吗?可是电动势不是w/q吗,不管新旧电池他发生的化学反应 2020-07-01 …
氢化阿托醛()是一种重要的化工原料,其合成路线如下:①Cl2光照②NaOH/醇△A③HBr/H2O 2020-07-21 …
人造奶油是以氢化的植物油、液体油和动物油为原料,按一定比例与乳化剂、色素、调味剂、强化剂、抗氧化剂、 2020-11-05 …
举例说明烯烃和炔烃的成键方式.催化氢化的详细过程及机理,乙炔的工业生产方法和应用速求~详细一点的最好 2020-11-20 …
油脂的硬化是油脂进行了()①氧化反应②氢化反应③加成反应④还原反应⑤皂化反应.A.①②③B.②③⑤C 2020-11-20 …
人造黄油在氢化的过程中,由于氢化不完全,导致其脂肪酸在结构上有一个或多个“非共轭反式双键”,这种不饱 2020-11-24 …