早教吧作业答案频道 -->化学-->
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点.①Ti的基态原子价电子排布式为.②Fe的基
题目详情
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点.
①Ti的基态原子价电子排布式为___.
②Fe的基态原子共有___种不同能级的电子.
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4═2KCl+2CrO2Cl2+3COCl2↑.
①上述化学方程式中非金属元素电负性由大到小的顺序是___(用元素符号表示).
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为___,中心原子的杂化方式为___.
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm.则熔点:NiO___(填“>”、“<”或“=”)FeO.
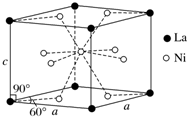
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化.该合金的晶胞结构如图所示.
①该晶体的化学式为___.
②已知该晶胞的摩尔质量为M g•mol-1,密度为d g•cm-3.设NA为 阿 伏加德罗常数的值,则该晶胞的体积是___ cm3(用含M、d、NA的代数式表示).
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定.已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g•cm-3;储氢能力=
.若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___.

(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点.
①Ti的基态原子价电子排布式为___.
②Fe的基态原子共有___种不同能级的电子.
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4═2KCl+2CrO2Cl2+3COCl2↑.
①上述化学方程式中非金属元素电负性由大到小的顺序是___(用元素符号表示).
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为___,中心原子的杂化方式为___.
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm.则熔点:NiO___(填“>”、“<”或“=”)FeO.
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化.该合金的晶胞结构如图所示.
①该晶体的化学式为___.
②已知该晶胞的摩尔质量为M g•mol-1,密度为d g•cm-3.设NA为 阿 伏加德罗常数的值,则该晶胞的体积是___ cm3(用含M、d、NA的代数式表示).
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定.已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g•cm-3;储氢能力=
| 储氢后氢气的密度 |
| 标准状况下氢气的密度 |
▼优质解答
答案和解析
(1)①Ti是22号元素,位于元素周期表中第四周期第IVB族,故Ti的基态原子价电子排布式为 3d24s2,故答案为:3d24s2;
②Fe是26号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,故答案为:7;
(2)①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,CrO2Cl2中Cl为+1价,O为-2价,电负性越大,对键合电子吸引力越大,元素相互化合时该元素表现负价,故电负性:O>Cl>C,故答案为:O>Cl>C;
②COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,中心原子C电子对数=3+
=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(4)①该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点.
所以晶胞实际含有的镍原子为1×1+
×8=5,晶胞实际含有的镧原子为8×
=1,所以晶体的化学式LaNi5,故答案为:LaNi5;
②一个晶胞的质量m=
,根据m=ρv,即v=
,故答案为:
;
③LaNi5合金储氢后的密度ρ=
=
=0.111g•cm-3,由定义式:储氢能力=
,故储氢能力=
≈1236,故答案为:1236.
②Fe是26号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,故答案为:7;
(2)①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,CrO2Cl2中Cl为+1价,O为-2价,电负性越大,对键合电子吸引力越大,元素相互化合时该元素表现负价,故电负性:O>Cl>C,故答案为:O>Cl>C;
②COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,中心原子C电子对数=3+
| 4-1×2-2 |
| 2 |
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(4)①该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点.
所以晶胞实际含有的镍原子为1×1+
| 1 |
| 2 |
| 1 |
| 8 |
②一个晶胞的质量m=
| M |
| NA |
| M |
| NA•d |
| M |
| NA•d |
③LaNi5合金储氢后的密度ρ=
| m(晶胞中的H) |
| V(晶胞) |
| 1×6 |
| NA×(511×10-10)2×sin60°×397×10-10 |
| 储氢后氢气的密度 |
| 标准状况下氢气的密度 |
| 0.111g•cm-3 |
| 8.98×10-5g•cm-3 |
看了 钛、铬、铁、镍、铜等金属及其...的网友还看了以下:
求组合排列排列的公式,假设有2个基础数:A和B,排列出来为:AB,BA,只有两种,基础数不能算进去 2020-05-14 …
三个不同的氨基酸与三种不同的氨基酸排列的区别如题;三个不同的氨基酸可以合成三肽的种类、以及三种不同 2020-05-17 …
站3排多2个站4排多3个站5排多4个问:一共多少人?求解…T^T站3排多2个站4排多3个站5排多4 2020-06-11 …
某种鼠中,黄鼠基因Y对灰鼠基因y为显性,短尾基因T对长尾基因t为显性.且基因Y或t纯合时都能使胚胎 2020-06-26 …
DNA分子中碱基A与T配对,C与G配对,下列对双链DNA分子中(A+T):(C+G)的叙述正确的是 2020-07-21 …
已知某植物的花色有红色、粉红色和白色三种,受S、s和T、t两对等位基因控制,S基因控制红色素的合成, 2020-11-20 …
近来韩国组合排挤事件~求解~~T-ara排挤门曝光后,演艺界相关人士表示:“很多很红的偶像组合往往会 2020-11-28 …
.某双链DNA分子中,作为模板链的部分碱基的排列顺序是:G—C—A—G—T—A—C—C—G—C—G— 2020-11-29 …
某种鼠中,黄鼠基因R对灰鼠基因r为显性,短尾基因T对长尾基因t为显性。且基因R或t纯合时都能使胚胎致 2021-01-13 …
下列有关DNA分子结构的叙述中,正确的是()A.腺嘌呤(A)与胸腺嘧啶(T)之间通过肽键连接B.碱基 2021-01-22 …