早教吧作业答案频道 -->化学-->
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿[主要成分是钛酸亚铁(FeTiO3),含有Fe(Ⅲ)等杂质]
题目详情
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿[主要成分是钛酸亚铁(FeTiO3),含有Fe(Ⅲ)等杂质],同时获得副产品甲的工业生产流程如下:
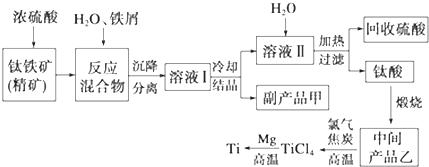
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式___
(2)上述生产流程中加入铁屑的目的是___,可循环利用的物质是___,检验副产品甲是否变质的实验方法是___
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于___时,Mg(OH)2开始沉淀
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:___.
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式___.
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是___,反应后的产物需要加入___溶解后才能达到提纯金属钛的目的.

(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式___
(2)上述生产流程中加入铁屑的目的是___,可循环利用的物质是___,检验副产品甲是否变质的实验方法是___
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:___.
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式___.
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是___,反应后的产物需要加入___溶解后才能达到提纯金属钛的目的.
▼优质解答
答案和解析
钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质)中加入浓硫酸,FeTiO3发生反应:FeTiO3+2H2SO4(浓)
TiOSO4(硫酸氧钛)+FeSO4+2H2O,钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,溶液Ⅰ中含有FeSO4和TiOSO4,溶液Ⅱ主要含有TiOSO4,加入水,加热可水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,
(1)加入浓硫酸,FeTiO3发生反应:FeTiO3+2H2SO4(浓)
TiOSO4(硫酸氧钛)+FeSO4+2H2O,
故答案为:FeTiO3+2H2SO4(浓)
TiOSO4(硫酸氧钛)+FeSO4+2H2O;
(2)铁可与Fe3+反应生成Fe2+,加入铁屑,可防止Fe2+氧化,从流程图硫酸与过量的铁反应可知,副产品甲是FeSO4•7H2O,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质,
故答案为:防止Fe2+氧化成Fe3+;硫酸;取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质;
(3)①Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.8×10-11,故c(OH-)=
=10-4,故c(H+)=
=10-10,故此时pH=10,故答案为:10;
②已知TiO2+发生水解生成钛酸(H2TiO3)沉淀和氢离子,其离子方程式为:TiO2++2H2O═H2TiO3↓+2H+,
故答案为:TiO2++2H2O═H2TiO3↓+2H+;
(4)中间产物乙为TiO2,TiO2与焦炭、氯气在高温下发生反应生成四氯化钛和一氧化碳,反应的方程式为:TiO2+2Cl2+2C
TiCl4+2CO,
故答案为:TiO2+2Cl2+2C
TiCl4+2CO;
(5)为防止碳与氧气反应,应可绝空气加热,反应后的产物需要加入稀盐酸(或稀硫酸)镁溶解后才能达到提纯金属钛的目的,
故答案为:隔绝空气;稀盐酸(或稀硫酸).
| ||
(1)加入浓硫酸,FeTiO3发生反应:FeTiO3+2H2SO4(浓)
| ||
故答案为:FeTiO3+2H2SO4(浓)
| ||
(2)铁可与Fe3+反应生成Fe2+,加入铁屑,可防止Fe2+氧化,从流程图硫酸与过量的铁反应可知,副产品甲是FeSO4•7H2O,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质,
故答案为:防止Fe2+氧化成Fe3+;硫酸;取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质;
(3)①Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.8×10-11,故c(OH-)=
|
| 10-14 |
| 10-4 |
②已知TiO2+发生水解生成钛酸(H2TiO3)沉淀和氢离子,其离子方程式为:TiO2++2H2O═H2TiO3↓+2H+,
故答案为:TiO2++2H2O═H2TiO3↓+2H+;
(4)中间产物乙为TiO2,TiO2与焦炭、氯气在高温下发生反应生成四氯化钛和一氧化碳,反应的方程式为:TiO2+2Cl2+2C
| ||
故答案为:TiO2+2Cl2+2C
| ||
(5)为防止碳与氧气反应,应可绝空气加热,反应后的产物需要加入稀盐酸(或稀硫酸)镁溶解后才能达到提纯金属钛的目的,
故答案为:隔绝空气;稀盐酸(或稀硫酸).
看了 金属钛(Ti)因其硬度大、熔...的网友还看了以下:
高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存 2020-07-04 …
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸 2020-07-11 …
钛(Ti)因其硬度大、熔点高,常温下耐酸碱、耐腐蚀等优良性能而被认为是本世纪的重要金属材料.钛的提 2020-07-11 …
金属钛(Ti)的合金具有耐高温、耐腐蚀、强度高等性能,钛合金广泛用于航空、航天工业及化学工业。工业 2020-07-11 …
金属钛(Ti)因为有神奇的性能越来越引起人们的关注,钛是航空、军工、电力等领域的重要的原材料.地壳 2020-07-28 …
金属钛被称为铁和铝之后崛起的“第三金属”,钛的硬度大、熔点高、常温下耐酸碱、耐腐蚀,是航海、化工、医 2020-11-24 …
2013年12月15日嫦娥三号着陆器与巡视器分离,“玉兔号”巡视器顺利抵达月球表面.为了应对月球的特 2020-12-07 …
钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原 2020-12-07 …
钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原 2020-12-26 …
钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原 2020-12-26 …