早教吧作业答案频道 -->化学-->
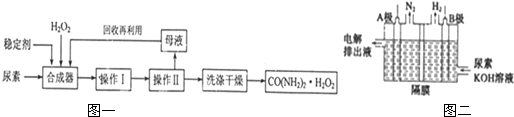
尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂-过氧化尿素[CO(NH2)2•H2O2],其合成工艺流程如图一所示:请回答下列问题:(1)操作I、II的名称分别是
题目详情
尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂-过氧化尿素[CO(NH2)2•H2O2],其合成工艺流程如图一所示:
请回答下列问题:
(1)操作I、II的名称分别是___、___.CO(NH2)2•H2O2分子中尿素和过氧化氢之间以___结合,其结合力较弱,具有尿素和过氧化氢双重性质.
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:___.
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:
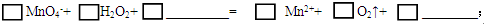
②计算出产品中H2O2的质量分数为___.
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图二所示.电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极.B极连接电源的___极(填“正”或“负”),阳极电极反应方程为___.

请回答下列问题:
(1)操作I、II的名称分别是___、___.CO(NH2)2•H2O2分子中尿素和过氧化氢之间以___结合,其结合力较弱,具有尿素和过氧化氢双重性质.
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:___.
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:
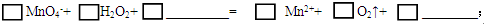
②计算出产品中H2O2的质量分数为___.
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图二所示.电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极.B极连接电源的___极(填“正”或“负”),阳极电极反应方程为___.
▼优质解答
答案和解析
(1)因为过氧化尿素具有尿素和过氧化氢双重性质,受热易分解,所以应使溶液在较低温度下蒸发,因此操作I、II的名称分别是低温蒸发、过滤;CO(NH2)2•H2O2分子中尿素和过氧化氢都已经达到稳定结构,二者之间的结合力较弱,应该为氢键;
故答案为:低温蒸发;过滤;氢键;
(2)首先写出CH4与H2O反应的化学方程式并注明状态,然后根据盖斯定律求焓变,△H=-890.3kJ•mol‾1+4×285.8kJ•mol‾1-2×44kJ•mol‾1 =+164.9 kJ•mol‾1,可得热化学方程式为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+164.9 kJ/mol;
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+164.9 kJ/mol;
(3)①根据氧化还原反应中,化合价升高的价数和降低相等,MnO4‾中Mn元素降低5价,H2O2中O元素升高1价,所以MnO4‾和Mn2+的系数为2,H2O2和O2的系数为5,然后利用观察法配平化学方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
②根据2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,反应时KMnO4与H2O2的物质的量之比为2:5,可得产品中H2O2的质量分数=0.2mol/L×0.02L×
×10×34g/mol÷12g×100%=28.3%;
故答案为:28.3%;
(4)根据图示,B极发生H+得电子生成H2,所以B为阴极,连接电源的负极;阳极CO(NH2)2失去电子转化为N2,因为电解液含KOH,所以电极方程式为:CO(NH2)2-6e-+8OH-═N2↑+CO32-+6H2O;
故答案为:负;CO(NH2)2-6e-+8OH-=N2↑+CO32-+6H2O.
故答案为:低温蒸发;过滤;氢键;
(2)首先写出CH4与H2O反应的化学方程式并注明状态,然后根据盖斯定律求焓变,△H=-890.3kJ•mol‾1+4×285.8kJ•mol‾1-2×44kJ•mol‾1 =+164.9 kJ•mol‾1,可得热化学方程式为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+164.9 kJ/mol;
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+164.9 kJ/mol;
(3)①根据氧化还原反应中,化合价升高的价数和降低相等,MnO4‾中Mn元素降低5价,H2O2中O元素升高1价,所以MnO4‾和Mn2+的系数为2,H2O2和O2的系数为5,然后利用观察法配平化学方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
②根据2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,反应时KMnO4与H2O2的物质的量之比为2:5,可得产品中H2O2的质量分数=0.2mol/L×0.02L×
| 5 |
| 2 |
故答案为:28.3%;
(4)根据图示,B极发生H+得电子生成H2,所以B为阴极,连接电源的负极;阳极CO(NH2)2失去电子转化为N2,因为电解液含KOH,所以电极方程式为:CO(NH2)2-6e-+8OH-═N2↑+CO32-+6H2O;
故答案为:负;CO(NH2)2-6e-+8OH-=N2↑+CO32-+6H2O.
看了 尿素可作为H2O2的稳定载体...的网友还看了以下:
稳定的氧化物是什么为什么S燃烧生成的稳定氧化物是2氧化硫而不是3氧化硫 2020-03-30 …
过氧化氢制氧要得到平稳的氧气流应如何操作? 2020-03-31 …
怎么样可以制取比较平稳的氧气流?制取“平稳”的氧气流~是把过氧化氢缓缓加入盛有二氧化锰的试管里还是把 2020-03-31 …
阳极氧化请问哪位高手能告诉我阳极和氧化是否为同一个工艺啊?如果不是它们的区别在哪里?阳极过后的产品 2020-07-05 …
若分解过氧化氢制取氧气,供选用的装置如图:要得到平稳的氧气流,应选用的发生装置是(选填“甲”或“乙 2020-07-22 …
制氧气的气流如何平稳是二氧化锰放入过氧化氢溶液中能得到平稳的氧气气流?还是过氧化氢滴加入二氧化锰中 2020-07-22 …
若分解过氧化氢制取氧气,供选用的装置如下:(1)要得到平稳的氧气流,应选用的发生装置是(选填“A”或 2020-11-29 …
过氧化氢制氧要得到平稳的氧气流应如何操作? 2020-12-20 …
过氧化氢制氧要得到平稳的氧气流应如何操作? 2020-12-20 …
为什么先放过氧化氢再放二氧化锰?如果颠倒顺序会不会对现象有影响?先加入什么可以得到平稳的氧气流?#1 2020-12-20 …