早教吧作业答案频道 -->化学-->
天津港“8.12”爆炸事故中,应爆炸冲击导致氰化钠有少量泄露,可通过喷洒硫代硫酸钠溶液处理,以减少污染.(1)氰化钠(NaCN)溶液呈碱性,其原因是(用离子方程式解释).(2)氰
题目详情
天津港“8.12”爆炸事故中,应爆炸冲击导致氰化钠有少量泄露,可通过喷洒硫代硫酸钠溶液处理,以减少污染.
(1)氰化钠(NaCN)溶液呈碱性,其原因是___(用离子方程式解释).
(2)氰化钠于硫代硫酸钠的反应为:NaCN+Na2S2O3=NaSCN+Na2SO3;已知:NaSCN中S为-2价,去掉1molNaCN,碳原子失去电子的物质的量为___.
某化学兴趣小组在实验室制备硫代硫酸钠,并探究用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放.
【实验一】实验室通过如下图所示装置制备Na2S2O3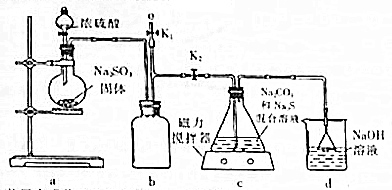
(3)上图a装置中盛放Na2SO3固体的仪器名称是___.
(4)b装置的作用是___.
(5)装置c中的产物有Na2S2O3和CO2气体等,实验后,装置d中的溶质有NaOH、Na2CO3看,还可能有___、___.
(6)实验结束后,在e处最好连接盛___(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置是污染空气.
【实验二】已知:
①废水中氰化钠含量的最高排放标准为0.5mg/L.
②Ag++2CN-=[Ag(CN)2],Ag++I-=AgI↓;AgI是黄色,且CN-优先于Ag+反应.
测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量,实验如下:
取2500ml处理后的氰化钠废水于锥形瓶中;在锥形瓶中滴加几滴KI溶液作指示剂;用0.0001mol/L的AgNO3溶液滴定,平均消耗AgNO3溶液的体积为2.50ml.
(7)滴定终点的判断依据是___.
(8)处理后的废水中氰化钠的含量为___mg/L,能否达标排放?___.(填“能”或“不能”)
(1)氰化钠(NaCN)溶液呈碱性,其原因是___(用离子方程式解释).
(2)氰化钠于硫代硫酸钠的反应为:NaCN+Na2S2O3=NaSCN+Na2SO3;已知:NaSCN中S为-2价,去掉1molNaCN,碳原子失去电子的物质的量为___.
某化学兴趣小组在实验室制备硫代硫酸钠,并探究用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放.
【实验一】实验室通过如下图所示装置制备Na2S2O3

(3)上图a装置中盛放Na2SO3固体的仪器名称是___.
(4)b装置的作用是___.
(5)装置c中的产物有Na2S2O3和CO2气体等,实验后,装置d中的溶质有NaOH、Na2CO3看,还可能有___、___.
(6)实验结束后,在e处最好连接盛___(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置是污染空气.
【实验二】已知:
①废水中氰化钠含量的最高排放标准为0.5mg/L.
②Ag++2CN-=[Ag(CN)2],Ag++I-=AgI↓;AgI是黄色,且CN-优先于Ag+反应.
测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量,实验如下:
取2500ml处理后的氰化钠废水于锥形瓶中;在锥形瓶中滴加几滴KI溶液作指示剂;用0.0001mol/L的AgNO3溶液滴定,平均消耗AgNO3溶液的体积为2.50ml.
(7)滴定终点的判断依据是___.
(8)处理后的废水中氰化钠的含量为___mg/L,能否达标排放?___.(填“能”或“不能”)
▼优质解答
答案和解析
(1)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN-+H2O⇌HCN+OH-,故答案为:CN-+H2O⇌HCN+OH-;
(2)在反应NaCN+Na2S2O3=NaSCN+Na2SO3中,碳从+2价升为+4价,所以去掉1molNaCN时,碳原子失去电子的物质的量为2mol,故答案为:2mol;
(3)根据装置图可知a装置中盛放Na2SO3固体的仪器名称是圆底烧瓶,故答案为:圆底烧瓶;
(4)根据装置图可知,装置B作安全瓶,可以防止倒吸,故答案为:防倒吸;
(5)装置C中发生的反应为Na2CO3、SO2、Na2S生成Na2S2O3和CO2气体,同时还有可能生成Na2SO3,装置d中的溶质有NaOH、Na2CO3,说明二氧化硫不足,反应中Na2S过量,所以装置c中还有可能有的物质为Na2SO3、Na2S,
故答案为:Na2SO3、Na2S;
(6)实验结束后,装置b中还有少量的氯气,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠与氯气能发生反应,所以在e处最好连接盛NaOH溶液的注射器,
故答案为:NaOH溶液;
(7)Ag+与CN-反应生成[Ag(CN)2],当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点,故滴定终点的判断依据是刚好有黄色沉淀析出,
故答案为:刚好有黄色沉淀析出;
(8)根据方程式Ag++2CN-=[Ag(CN)2],可知,当消耗AgNO3的物质的量为2.50ml×0.0001mol/L=2.50×10-7mol时,处理的废水中氰化钠的质量为2.45×10-5g,废水中氰化钠的含量为
=0.98mg/L>0.5mg/L,所以不能达到排放标准,
故答案为:0.98;不能.
(2)在反应NaCN+Na2S2O3=NaSCN+Na2SO3中,碳从+2价升为+4价,所以去掉1molNaCN时,碳原子失去电子的物质的量为2mol,故答案为:2mol;
(3)根据装置图可知a装置中盛放Na2SO3固体的仪器名称是圆底烧瓶,故答案为:圆底烧瓶;
(4)根据装置图可知,装置B作安全瓶,可以防止倒吸,故答案为:防倒吸;
(5)装置C中发生的反应为Na2CO3、SO2、Na2S生成Na2S2O3和CO2气体,同时还有可能生成Na2SO3,装置d中的溶质有NaOH、Na2CO3,说明二氧化硫不足,反应中Na2S过量,所以装置c中还有可能有的物质为Na2SO3、Na2S,
故答案为:Na2SO3、Na2S;
(6)实验结束后,装置b中还有少量的氯气,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠与氯气能发生反应,所以在e处最好连接盛NaOH溶液的注射器,
故答案为:NaOH溶液;
(7)Ag+与CN-反应生成[Ag(CN)2],当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点,故滴定终点的判断依据是刚好有黄色沉淀析出,
故答案为:刚好有黄色沉淀析出;
(8)根据方程式Ag++2CN-=[Ag(CN)2],可知,当消耗AgNO3的物质的量为2.50ml×0.0001mol/L=2.50×10-7mol时,处理的废水中氰化钠的质量为2.45×10-5g,废水中氰化钠的含量为
| 2.45×10 -5g |
| 2500ml |
故答案为:0.98;不能.
看了 天津港“8.12”爆炸事故中...的网友还看了以下:
暴走大事件12出了没 2020-04-27 …
一本故事书12元,一本字典65元.王老师用2000元钱先买了16本字典,余下的钱全部买故事书.还可 2020-05-13 …
阅读下面一段文字,完成下列各题。嫦娥奔月是一个家喻户晓的神话故事。12月2日凌晨,“嫦娥”怀抱“玉 2020-05-13 …
《西游记》前7回写什么的故事,8--12回写什么的故事,13--100回写什么的故事. 2020-05-23 …
阅读下面一段文字。嫦娥奔月是一个家喻户晓的神话故事。12月2日凌晨,“嫦娥”怀抱“玉兔”踏上奔月、 2020-06-18 …
9.指昏迷过去,失去知觉。也指不懂人情世故。()10.形容精神不振,提不起劲头。()11.比喻凭空 2020-06-19 …
P值怎么计算有两组数据:第一组野生型基因患者185例随访一年发生心血管事件36例第二组突变基因型患 2020-07-18 …
书店现有故事书做活动,买三本送二本.一本故事书12元,有336元最多能买几本书? 2020-07-19 …
一.鸡和鸭的只数比是3:5.①.在鸡和鸭的只数中鸡占()份,鸭占()份.二.小明,小刚,小强三人有故 2020-11-25 …
9.指昏迷过去,失去知觉。也指不懂人情世故。()10.形容精神不振,提不起劲头。()11.比喻凭空的 2020-12-22 …