早教吧作业答案频道 -->化学-->
氯碱工业过程中产生了大量的盐泥.某氯碱工厂的盐泥组成如表:成分NaClMg(OH)2CaCO3BaSO4SiO2等不溶于酸的物质质量分数(%)15~2015~205~1030~4010~15该
题目详情
氯碱工业过程中产生了大量的盐泥.某氯碱工厂的盐泥组成如表:
该工厂进一步利用盐泥生产了七水硫酸镁,设计了工艺流程如图1: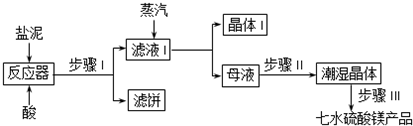
回答下列问题:
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式___.
(2)在滤饼中检测到硫酸钙的成分,其原因是___.
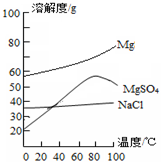
(3)已知一些盐的溶解度如图2.在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在___℃.
(4)步骤II操作是___,
(5)步骤III在工业上常用的设备是___(填字母).
A.加压干燥器B.蒸馏塔C.离心机D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4•7H2O的质量分数是___.
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |


回答下列问题:
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式___.
(2)在滤饼中检测到硫酸钙的成分,其原因是___.
(3)已知一些盐的溶解度如图2.在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在___℃.
(4)步骤II操作是___,
(5)步骤III在工业上常用的设备是___(填字母).
A.加压干燥器B.蒸馏塔C.离心机D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4•7H2O的质量分数是___.
▼优质解答
答案和解析
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,Mg(OH)2、CaCO3溶于硫酸生成硫酸钙和硫酸镁,反应的化学方程式为:
Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4⇌CaSO4+H2O+CO2↑,
故答案为:Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4⇌CaSO4+H2O+CO2↑.
(2)在滤饼中检测到硫酸钙的成分是因为CaCO3+H2SO4⇌CaSO4+H2CO3,加热有H2CO3
H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4,
故答案为:因为CaCO3+H2SO4⇌CaSO4+H2CO3,加热有H2CO3
H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4;
(3)在滤液I中通入高温水蒸气进行蒸发结晶,主要目的是使氯化钠能析出但硫酸镁不能析出,图象中溶解度分析可知选择80°C硫酸镁溶解度最大,
故答案为:80;
(4)步骤II的目的是从硫酸镁溶液中获得硫酸镁晶体,由于硫酸镁晶体带有结晶水,且根据硫酸镁的溶解度受温度影响的情况可知,要用冷却结晶的方法获得晶体,步骤II操作是冷却结晶、洗涤,得到潮湿的晶体,
故答案为:冷却结晶、洗涤;
(5)步骤III是潮湿的晶体得到七水硫酸镁晶体,可以用真空干燥器,真空干燥MgSO4•7H2O晶体防止失去结晶水,
故答案为:D;
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则
MgSO4•7H2O~Mg(OH)2~2NaOH,
1 2
n (V1mL×c1mol/L-V2mL×c2mol/L)×10-3L/ml
n=0.5×(V1mL×c1mol/L-V2mL×c2mol/L)×10-3L/ml=5×10-4×(c1V1-c2V2)mol
MgSO4•7H2O的质量分数=
×100%=
%.
故答案为:
%.
Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4⇌CaSO4+H2O+CO2↑,
故答案为:Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4⇌CaSO4+H2O+CO2↑.
(2)在滤饼中检测到硫酸钙的成分是因为CaCO3+H2SO4⇌CaSO4+H2CO3,加热有H2CO3
| ||
故答案为:因为CaCO3+H2SO4⇌CaSO4+H2CO3,加热有H2CO3
| ||
(3)在滤液I中通入高温水蒸气进行蒸发结晶,主要目的是使氯化钠能析出但硫酸镁不能析出,图象中溶解度分析可知选择80°C硫酸镁溶解度最大,
故答案为:80;
(4)步骤II的目的是从硫酸镁溶液中获得硫酸镁晶体,由于硫酸镁晶体带有结晶水,且根据硫酸镁的溶解度受温度影响的情况可知,要用冷却结晶的方法获得晶体,步骤II操作是冷却结晶、洗涤,得到潮湿的晶体,
故答案为:冷却结晶、洗涤;
(5)步骤III是潮湿的晶体得到七水硫酸镁晶体,可以用真空干燥器,真空干燥MgSO4•7H2O晶体防止失去结晶水,
故答案为:D;
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则
MgSO4•7H2O~Mg(OH)2~2NaOH,
1 2
n (V1mL×c1mol/L-V2mL×c2mol/L)×10-3L/ml
n=0.5×(V1mL×c1mol/L-V2mL×c2mol/L)×10-3L/ml=5×10-4×(c1V1-c2V2)mol
MgSO4•7H2O的质量分数=
| 5×10-4(c1V1-c2V2)mol×246g/mol |
| ag |
| 12.3(c1V1-c2V2) |
| a |
故答案为:
| 12.3(c1V1-c2V2) |
| a |
看了 氯碱工业过程中产生了大量的盐...的网友还看了以下:
某混合气体由两种气态烃组成.2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体折算成标准 2020-05-14 …
已知抛物线y=-x平方+2x+2 1)该抛物线的对称轴是 顶点坐标是 2)选取适当的数据填入下表并 2020-05-16 …
把一根绳分成两段,是他们的比为3:2,在把其中短的一段分成2:1的两段,这是最长的一段和最短的一段 2020-06-19 …
在标准状况下,将0.1molAl投入到1L0.1mol/的稀硫酸中充分反应,下列说法不正确的是() 2020-07-15 …
关于负数的非整次幂问题负数的奇次幂为正,偶次幂为负,那么负数的非整次幂的正负如何确定?还有(-2) 2020-07-31 …
已知在三角形OAB中,点C是以A为中心的点B的对称点.D是将向量OB分成2:1的一个内分点.向量D 2020-08-01 …
一道有关虚数的题目(化简)当我做虚数的化简时候,我化简来到1/i就结束了,但老师说一定要化成-i才能 2020-11-06 …
用算数解,要容易看懂,明明买3枝钢笔比买5枝圆珠笔多用3.1元,每枝圆珠笔2.5元,每枝钢笔多少元? 2020-11-06 …
请你用7L和3L的容器各一个,将10L的药液平均分成2份,该怎样分? 2020-12-07 …
某公司有15名员工,他们所在的部门及相应每人所创的年利润如下表:部门人数每人所创的年利润/万元A12 2020-12-31 …