早教吧作业答案频道 -->化学-->
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母序号).a.碳棒b.铜板c.锌板
题目详情
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择___(填字母序号).
a.碳棒 b.铜板 c.锌板 d.石墨块
(2)图2中,保护钢闸门C的方法叫___法.用氯化钠溶液模拟海水进行实验,D为石墨块,则如何检验D电极的产物___.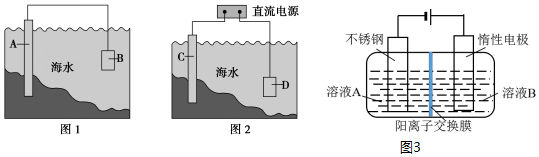
(3)以铬酸钾(K2CrO4)和KOH为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图(图3)如上. 溶液B是___,产物在___室( 填“阴极”或“阳极”)得到.测定混合液中K与Cr的物质的量之比为6:5,则此时铬酸钾的转化率为___.
已知:2CrO42-+2H+⇌Cr2O72- +H2O.
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择___(填字母序号).
a.碳棒 b.铜板 c.锌板 d.石墨块
(2)图2中,保护钢闸门C的方法叫___法.用氯化钠溶液模拟海水进行实验,D为石墨块,则如何检验D电极的产物___.

(3)以铬酸钾(K2CrO4)和KOH为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图(图3)如上. 溶液B是___,产物在___室( 填“阴极”或“阳极”)得到.测定混合液中K与Cr的物质的量之比为6:5,则此时铬酸钾的转化率为___.
已知:2CrO42-+2H+⇌Cr2O72- +H2O.
▼优质解答
答案和解析
(1)形成原电池时,Fe作正极被保护,则要选择活泼性比Fe强的金属作负极,所以选锌,故答案为:c;
(2)Fe作阴极被保护,保护钢闸门C的方法叫外加电流的阴极保护法;电解氯化钠溶液时阳极D上氯离子失电子生成氯气,其电极反应为:2Cl--2e-═Cl2↑,检验氯气用湿润的淀粉碘化钾试纸,即用湿润的淀粉碘化钾试纸放在阳极D附近,试纸变蓝,证明生成氯气;
故答案为:外加电流的阴极保护;湿润的淀粉碘化钾试纸放在阳极D附近,试纸变蓝,证明生成氯气;
(3)因为阳极氢氧根失电子发生氧化反应,又2CrO42-+2H+⇌Cr2O72-+H2O,所以溶液B是铬酸钾(K2CrO4)溶液,产物在阳极生成;
设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为
mol,对应的n(K)=xmol,n(Cr)=xmol,根据测定混合液中K与Cr的物质的量之比为6:5,则
=6:5,解得x=0.8,转化率为
×100%=80%,故答案为:K2CrO4溶液;阳极;80%.
(2)Fe作阴极被保护,保护钢闸门C的方法叫外加电流的阴极保护法;电解氯化钠溶液时阳极D上氯离子失电子生成氯气,其电极反应为:2Cl--2e-═Cl2↑,检验氯气用湿润的淀粉碘化钾试纸,即用湿润的淀粉碘化钾试纸放在阳极D附近,试纸变蓝,证明生成氯气;
故答案为:外加电流的阴极保护;湿润的淀粉碘化钾试纸放在阳极D附近,试纸变蓝,证明生成氯气;
(3)因为阳极氢氧根失电子发生氧化反应,又2CrO42-+2H+⇌Cr2O72-+H2O,所以溶液B是铬酸钾(K2CrO4)溶液,产物在阳极生成;
设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为
| x |
| 2 |
| 2(1-x)+x |
| 1-x+x |
| 0.8 |
| 1 |
看了 电化学原理在防止金属腐蚀、能...的网友还看了以下:
钢铁锈蚀的反应式是什么正负极有离子反应是正负离子反应的总反应 2020-03-30 …
科研难题...什么物质和水反应会产生大量气泡?条件:1.反应物质为固体 可以是两种以上的混合反应2 2020-05-17 …
●试题五 阅读下列程序说明和C程序,将应填入程序中(n)处的字句,写在答卷纸的对应栏内。 【程序说 2020-05-25 …
公司应明确员工的雇佣条件和考察评价的方法与程序,减少因雇佣不当而产生的安全风险。人员考查内容 2020-05-26 …
阅读下列程序说明和C程序,将应填入程序中(n)处的字句,写在对应栏内。【程序说明】 本程序先从文件读 2020-05-26 …
1、“匠”应查音序(),应查部首(),最后一笔是()。2、“缘故”的“缘1、“匠”应查音序(),应 2020-06-13 …
下列各项表述有误的一项是()A.“序”又称叙、叙文、叙言、序言、序文、引、引言、导言等,按类型可分 2020-06-19 …
(2005•白山一模)用铝制饭盒盛放醋,一段时间后饭盒被腐蚀,该腐蚀属腐蚀,相应的化学反应式为;如盛 2020-11-12 …
同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZ04>H2Y04>H3 2020-12-24 …
已知同周期的X、Y、Z三种元素的最高价氧化物水化物对应的酸性由强到弱的顺序是:HZO4>H2YO4> 2020-12-24 …