早教吧作业答案频道 -->化学-->
废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列方法回收钴、锂.已知:①Co(OH)2是两性氢氧化物.②氢氧化物Al(OH)3Fe(OH)3Fe(OH)3开始沉
题目详情
废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列方法回收钴、锂.
已知:
①Co(OH)2是两性氢氧化物.
②
请回答下列问题:
(1)浸出过程中为加快浸出速率,可以采取的措施有___(写出两点).
(2)浸出过程中Na2S2O3被氧化为Na2SO4的化学方程式为___.该过程中可用盐酸代替H2SO4和Na2S2O3,但缺点是___.
(3)滤渣的成分为___,充入空气的目的是___.
(4)沉钴过程中不使用NaOH溶液的原因是___.当溶液中c(Co2+)≤10-5mol•L-1时即认为沉淀完全,则需要控制x≥___(Ksp[Co(OH)2]=1.0×10-15).制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化成Co(OH)3,化学反应方程式为___.
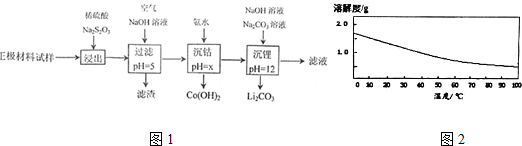
(5)碳酸锂的溶解度随温度的变化如右图所示,则洗涤碳酸锂沉淀时应选___(填“热水”或“冷水”).

已知:
①Co(OH)2是两性氢氧化物.
②
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
(1)浸出过程中为加快浸出速率,可以采取的措施有___(写出两点).
(2)浸出过程中Na2S2O3被氧化为Na2SO4的化学方程式为___.该过程中可用盐酸代替H2SO4和Na2S2O3,但缺点是___.
(3)滤渣的成分为___,充入空气的目的是___.
(4)沉钴过程中不使用NaOH溶液的原因是___.当溶液中c(Co2+)≤10-5mol•L-1时即认为沉淀完全,则需要控制x≥___(Ksp[Co(OH)2]=1.0×10-15).制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化成Co(OH)3,化学反应方程式为___.
(5)碳酸锂的溶解度随温度的变化如右图所示,则洗涤碳酸锂沉淀时应选___(填“热水”或“冷水”).
▼优质解答
答案和解析
废旧锂离子电池的正极材料主要含有LiCoO2(也表示为:Li2O•Co203)及少量Al、Fe等,向样品中加入稀硫酸、硫代硫酸钠,Na2S2O3被氧化为Na2SO4,Co3+被还原为Co2+,Al、Fe也溶解,然后向溶液中通入空气,Fe2+被氧化生成Fe3+,加入氢氧化钠溶液调节溶液pH=5,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,过滤除去,滤液中再加入氨水使Co2+转化为Co(OH)2沉淀,过滤后向滤液中加入Na2CO3,得到沉淀Li2CO3.
(1)浸出过程中为加快浸出速率,可以采取的措施有:充分搅拌、升高温度、增大酸的浓度、将正极材料粉碎等,
故答案为:充分搅拌、升高温度等;
(2)浸出过程中Na2S2O3被氧化为Na2SO4,+3价Co还原为+2Co,反应生成CoSO4、Li2SO4、Na2SO4与水,反应方程式为:8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O,用盐酸代替H2SO4和Na2S2O3,会氧化生成氯气,污染环境,
故答案为:8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O;生成氯气,污染环境;
(3)滤渣的成分为Al(OH)3、Fe(OH)3;溶液中通入空气将Fe2+被氧化为Fe3+,以便调节pH转化为沉淀,过滤除去,
故答案为:Al(OH)3、Fe(OH)3;将Fe2+被氧化为Fe3+;
(4)Co(OH)2是两性氢氧化物,NaOH溶液可以溶解Co(OH)2,导致固体质量减少,
当溶液中c(Co2+)≤10-5mol•L-1时即认为沉淀完全,根据Ksp[Co(OH)2]=c(Co2+)×c2(OH-)=1.0×10-15,可知c(OH-)=10-5mol•L-1,故c(H+)=10-9mol•L-1,则控制溶液pH≥9,
Co(OH)2会被空气中的O2氧化成Co(OH)3,与氢氧化亚铁氧化类似,反应方程式为:4Co(OH)2+O2+2H2O=4Co(OH)3,
故答案为:Co(OH)2是两性氢氧化物,能与NaOH溶液反应导致沉淀的质量减少;9;4Co(OH)2+O2+2H2O=4Co(OH)3;
(5)碳酸锂的溶解度随温度的升高而减小,应采取热水洗涤,减少因溶解导致的损失,
故答案为:热水.
(1)浸出过程中为加快浸出速率,可以采取的措施有:充分搅拌、升高温度、增大酸的浓度、将正极材料粉碎等,
故答案为:充分搅拌、升高温度等;
(2)浸出过程中Na2S2O3被氧化为Na2SO4,+3价Co还原为+2Co,反应生成CoSO4、Li2SO4、Na2SO4与水,反应方程式为:8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O,用盐酸代替H2SO4和Na2S2O3,会氧化生成氯气,污染环境,
故答案为:8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O;生成氯气,污染环境;
(3)滤渣的成分为Al(OH)3、Fe(OH)3;溶液中通入空气将Fe2+被氧化为Fe3+,以便调节pH转化为沉淀,过滤除去,
故答案为:Al(OH)3、Fe(OH)3;将Fe2+被氧化为Fe3+;
(4)Co(OH)2是两性氢氧化物,NaOH溶液可以溶解Co(OH)2,导致固体质量减少,
当溶液中c(Co2+)≤10-5mol•L-1时即认为沉淀完全,根据Ksp[Co(OH)2]=c(Co2+)×c2(OH-)=1.0×10-15,可知c(OH-)=10-5mol•L-1,故c(H+)=10-9mol•L-1,则控制溶液pH≥9,
Co(OH)2会被空气中的O2氧化成Co(OH)3,与氢氧化亚铁氧化类似,反应方程式为:4Co(OH)2+O2+2H2O=4Co(OH)3,
故答案为:Co(OH)2是两性氢氧化物,能与NaOH溶液反应导致沉淀的质量减少;9;4Co(OH)2+O2+2H2O=4Co(OH)3;
(5)碳酸锂的溶解度随温度的升高而减小,应采取热水洗涤,减少因溶解导致的损失,
故答案为:热水.
看了 废旧锂离子电池的正极材料试样...的网友还看了以下:
*o***e/*i**/**i*e/m**k/*h*ck**/*r*a/h*******r/**a* 2020-03-30 …
英文字母概念好的帮忙一下...T、H、C、N、E、O、I让你联想到什么(词)?要有意思的词,不是的 2020-04-09 …
多音字组词。塞sāi()度dù()摩mó()刨páo()sài()duó()mā()bào()号h 2020-06-28 …
下列词语中加点字的读音全都正确的一项是()A.饿殍(piǎo)孝悌(dì)厚德载物(zài)乍暖还 2020-07-02 …
下列词语中加点字的读音全都正确的一项是()A.饿殍(piǎo)孝悌(dì)厚德载物(zài)乍暖还 2020-07-02 …
A/O排泥问题:arm:A/O后面有个沉淀池.排泥是只排沉淀池的泥么?如果是这样,想保证A/O的泥 2020-07-07 …
英语高手傍忙拼几个单词!X,I,A,O,F,E,I,W,O,A,I,N,I打头的 2020-07-13 …
求大神帮忙写一篇英文短文16句话每句依次以“H,O,W,I,S,T,I,L,L,L,O,V,E,Y, 2020-11-26 …
英语向高人求教!写几句话.每句开头的第一个字母分别是“L,i,U,F,E,i,F,E,i,w,o,a 2020-12-15 …
.线性表(a1,a2,…,an)以链接方式存储时,访问第i位置元素的时间复杂性为()A.O(i)B. 2021-01-14 …