早教吧作业答案频道 -->化学-->
ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.②ClO2易爆炸,若用“惰性气体”等稀释时
题目详情
ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.
②ClO2易爆炸,若用“惰性气体”等稀释时,爆炸的可能性大大降低.
③装置A中发生反应:H2C2O4+H2SO4+2KC1O3═K2SO4+2CO2↑+2ClO2↑+2H2O
④HClO2是强酸.
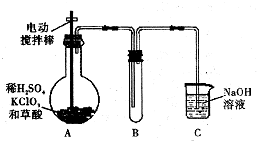
(1)A装置中电动搅拌棒的作用是___.
(2)B装置需放在冰水中,原因是___.
(3)用H2C2O4、稀硫酸和KClO3制备ClO2的最大优点是___.
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含
量,进行下列实验:
步骤1:准确量取V1mL ClO2溶液加入到锥形瓶中.,
步骤2:用稀硫酸调节Cl02溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol.L-1Na2S2O3溶液滴定至终点,消耗Na2S203溶液V2mL.
(已知2ClO2+8H++10I-=2Cl-+5I2+4H2O,2S2O32-+I2=2I-+S4O62-)
①配制100mL cmol-L-lNa2S203标准溶液时,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和___.
②原溶液中ClO2的含量为___ g/L(用含字母的代数式表示).
(5)工业上生产ClO2和NaCIO2的工艺流程如图:
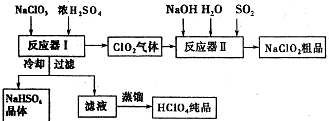
①反应器I中发生反应的化学方程式为___.
②反应器Ⅱ中发生反应的离子方程式为___.
③在碱性溶液中NaClO2比较稳定,所以反应器Ⅱ中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是___.
②ClO2易爆炸,若用“惰性气体”等稀释时,爆炸的可能性大大降低.
③装置A中发生反应:H2C2O4+H2SO4+2KC1O3═K2SO4+2CO2↑+2ClO2↑+2H2O
④HClO2是强酸.

(1)A装置中电动搅拌棒的作用是___.
(2)B装置需放在冰水中,原因是___.
(3)用H2C2O4、稀硫酸和KClO3制备ClO2的最大优点是___.
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含
量,进行下列实验:
步骤1:准确量取V1mL ClO2溶液加入到锥形瓶中.,
步骤2:用稀硫酸调节Cl02溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol.L-1Na2S2O3溶液滴定至终点,消耗Na2S203溶液V2mL.
(已知2ClO2+8H++10I-=2Cl-+5I2+4H2O,2S2O32-+I2=2I-+S4O62-)
①配制100mL cmol-L-lNa2S203标准溶液时,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和___.
②原溶液中ClO2的含量为___ g/L(用含字母的代数式表示).
(5)工业上生产ClO2和NaCIO2的工艺流程如图:

①反应器I中发生反应的化学方程式为___.
②反应器Ⅱ中发生反应的离子方程式为___.
③在碱性溶液中NaClO2比较稳定,所以反应器Ⅱ中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是___.
▼优质解答
答案和解析
(1)A装置中电动搅拌棒,增大反应物的接触面积,加快反应速率,
故答案为:反应时搅拌,增大反应物的接触面积,加快反应速率;
(2)ClO2是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,B装置要放置在冰水中,使ClO2 冷凝,便于收集,
故答案为:使ClO2 冷凝,便于收集;
(3)信息②中ClO2易爆炸,若用“惰性气体”等稀释时,爆炸的可能性大大降低,而反应生成二氧化碳,可以稀释ClO2,大大降低了爆炸的可能性,
故答案为:反应生成二氧化碳,可以稀释ClO2,大大降低了爆炸的可能性;
(4)①称量后在烧杯中溶解,并用玻璃棒搅拌,移入100mL容量瓶中,加水至距离容量瓶刻度线1-2cm处改用胶头滴管定容,
故答案为:100mL容量瓶;
②由反应可得关系式:2ClO2~5I2~10S2O32-,可知V1mL×c(ClO2):V2mL×c(Na2S2O3)=2:10,则V1mL×c(ClO2):V2mL×c mol.L-1,故c(ClO2)=
mol/L,则其含量为
mol/L×67.5g/mol=
g/L,
故答案为:
g/L;
(5)①由流程图可知,反应器I中浓硫酸与氯酸钠反应生成ClO2、NaClO2、硫酸氢钠,反应方程式为:3NaClO3+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O,
故答案为:3NaClO3+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;
②反应器Ⅱ中是ClO2、NaOH、SO2反应生成NaClO2,根据电子转移守恒,SO2被氧化为硫酸钠,溶液离子方程式为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
③HClO2是强酸,NaClO2溶液呈中性,连续测定反应器Ⅱ内溶液的pH,可以判断NaOH是否过量,故答案为:连续测定反应器Ⅱ内溶液的pH.
故答案为:反应时搅拌,增大反应物的接触面积,加快反应速率;
(2)ClO2是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,B装置要放置在冰水中,使ClO2 冷凝,便于收集,
故答案为:使ClO2 冷凝,便于收集;
(3)信息②中ClO2易爆炸,若用“惰性气体”等稀释时,爆炸的可能性大大降低,而反应生成二氧化碳,可以稀释ClO2,大大降低了爆炸的可能性,
故答案为:反应生成二氧化碳,可以稀释ClO2,大大降低了爆炸的可能性;
(4)①称量后在烧杯中溶解,并用玻璃棒搅拌,移入100mL容量瓶中,加水至距离容量瓶刻度线1-2cm处改用胶头滴管定容,
故答案为:100mL容量瓶;
②由反应可得关系式:2ClO2~5I2~10S2O32-,可知V1mL×c(ClO2):V2mL×c(Na2S2O3)=2:10,则V1mL×c(ClO2):V2mL×c mol.L-1,故c(ClO2)=
| cV2 |
| 5V1 |
| cV2 |
| 5V1 |
| 13.5cV2 |
| V1 |
故答案为:
| 13.5cV2 |
| V1 |
(5)①由流程图可知,反应器I中浓硫酸与氯酸钠反应生成ClO2、NaClO2、硫酸氢钠,反应方程式为:3NaClO3+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O,
故答案为:3NaClO3+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;
②反应器Ⅱ中是ClO2、NaOH、SO2反应生成NaClO2,根据电子转移守恒,SO2被氧化为硫酸钠,溶液离子方程式为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
③HClO2是强酸,NaClO2溶液呈中性,连续测定反应器Ⅱ内溶液的pH,可以判断NaOH是否过量,故答案为:连续测定反应器Ⅱ内溶液的pH.
看了 ClO2是一种高效水处理剂,...的网友还看了以下:
求一部核武器电影,影片由几个人背住爆炸力极强的液体核武器向雪山上,其中一个在太阳的照射下发生爆炸! 2020-05-13 …
暖手宝里有一个类似日字形状的东西,这是电极式的暖手宝么我见网上说电极的容易爆炸,电极式的就是摸着是 2020-05-14 …
有媒体经常报道一些具有独特性质的化学物质,如:改变世界的新材料一石墨烯、爆炸力极强的N5、比黄金还 2020-05-14 …
测COD时加了防爆沸的玻璃珠怎么气还直冲?冷凝管一会碰碰的,气往上像爆炸一样的!可我已经加过防爆沸 2020-05-20 …
这句话用英语怎么说呢?比如恐怖恐怖主义前年在伦敦地铁的爆炸案,极大的扰乱了社会秩序. 2020-06-22 …
这几次太阳活动造成的影响是()A、使到达地球的可见光增强,紫外线有所减少B、出现电离层的扰动,短波无 2020-11-16 …
春节燃烧烟花爆竹是我国的传统习俗,2007年春节,我市开始有限解禁烟花爆竹的燃放,使今年烟花爆竹的燃 2020-12-08 …
耀斑等太阳活动造成的影响是[]A.使到达地球的可见光增强,紫外线有所减少B.出现电离层的扰动,短波通 2020-12-10 …
春节燃放烟花爆竹是我国的传统习俗.2006年春节,不少城市开始有限解禁烟花爆竹的燃放,使今年烟花爆竹 2021-01-18 …
春节燃烧烟花爆竹是我国的传统习俗,2007年春节,我市开始有限解禁烟花爆竹的燃放,使今年烟花爆竹的燃 2021-01-18 …