早教吧作业答案频道 -->化学-->
亚铁氰化钾(K4Fe(CN)6,黄血盐)在化学实验、电镀、食品添加剂及医学上有广泛用途.还可用于冶疗铊(Tl)中毒,烧制青花瓷时可用于绘画等.已知HCN是一种极弱的酸.现有一种用含NaCN
题目详情
亚铁氰化钾(K4Fe(CN)6,黄血盐)在化学实验、电镀、食品添加剂及医学上有广泛用途.还可用于冶疗铊(Tl)中毒,烧制青花瓷时可用于绘画等.已知HCN是一种极弱的酸.现有一种用含NaCN废水合成黄血盐的主要工艺流程如图: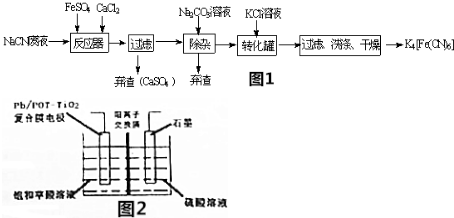
(1)实验室用NaCN固体配制NaCN溶液时,应先将其溶于___溶液,再用蒸馏水稀释.
(2)流程中经过滤、洗涤、干燥后得到K4[Fe(CN)6].过滤实验中使用的玻璃仪器有烧杯、玻璃棒、___、铁架台.
(3)流程图中加入碳酸钠溶液的主要目的是___.
(4)烧制青花瓷时,瓷器表面的暗红色涉及辉铜矿制取铜的反应.其过程如下:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___.
(5)工业上常用草酸(H2C2O4)来洗涤反应后的转化罐,草酸也可以用于制备高档香料乙醛酸(H2C2O3),装置如图2所示,写出复合膜电极的电极反应式___.
(6)环保局对某电镀厂排放的NaCN溶液,进行检测.取NaCN废液1L,浓缩到20mL,加入适量硫酸酸化,用滴定管加入过量的0.10mol/L的H2O2共计15mL,产生两种无毒气体,请写出该离子反应方程式___;
再用0.02mol/L的酸性KMnO4溶液滴定过程的H2O2,实验测得消耗KMnO4溶液的平均值为10.00mL,该废水NaCN的浓度为___g/L.(已知废水中的杂质不参与反应)

(1)实验室用NaCN固体配制NaCN溶液时,应先将其溶于___溶液,再用蒸馏水稀释.
(2)流程中经过滤、洗涤、干燥后得到K4[Fe(CN)6].过滤实验中使用的玻璃仪器有烧杯、玻璃棒、___、铁架台.
(3)流程图中加入碳酸钠溶液的主要目的是___.
(4)烧制青花瓷时,瓷器表面的暗红色涉及辉铜矿制取铜的反应.其过程如下:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___.
(5)工业上常用草酸(H2C2O4)来洗涤反应后的转化罐,草酸也可以用于制备高档香料乙醛酸(H2C2O3),装置如图2所示,写出复合膜电极的电极反应式___.
(6)环保局对某电镀厂排放的NaCN溶液,进行检测.取NaCN废液1L,浓缩到20mL,加入适量硫酸酸化,用滴定管加入过量的0.10mol/L的H2O2共计15mL,产生两种无毒气体,请写出该离子反应方程式___;
再用0.02mol/L的酸性KMnO4溶液滴定过程的H2O2,实验测得消耗KMnO4溶液的平均值为10.00mL,该废水NaCN的浓度为___g/L.(已知废水中的杂质不参与反应)
▼优质解答
答案和解析
实验目的是合成黄血盐,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,然后加入碳酸钠溶液可除去过量的Ca2+,经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6,说明K4[Fe(CN)6溶解度较小,
(1)NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,NaCN水解呈碱性的离子方程式为:CN-+H2O⇌HCN+OH-,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,在加水稀释,
故答案为:NaOH;
(2)流程中经过滤、洗涤、干燥后得到K4[Fe(CN)6].过滤实验中使用的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:漏斗;
(3)反应器中加入氯化钙,加入碳酸钠溶液可除去过量的Ca2+,
故答案为:除去其中的Ca2+;
(4)①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ/mol
依据盖斯定律计算(①+②)×
得到由Cu2S与O2加热反应生成Cu的热化学方程式为:Cu2S(s)+O2(g)=)=2Cu(s)+SO2(g)△H=-652.2KJ/mol,
故答案为:Cu2S(s)+O2(g)=)=2Cu(s)+SO2(g)△H=-652.2KJ/mol;
(5)草酸(HOOCCOOH)在阴极上得电子生成OHCCOOH,阴极反应式为:HOOCCOOH+2H++2e-═OHCCOOH+H2O,
故答案为:HOOCCOOH+2H+OHCCOOH+H2O;
(6)取NaCN废液1L,浓缩到20mL,加入适量硫酸酸化得到的氰化氢与双氧水反应生成两种无毒气体为氮气和二氧化碳,反应的离子方程式为:2H++2CN-+5H2O2=N2+2CO2+6H2O,再用0.02mol/L的酸性KMnO4溶液滴定过程的H2O2,实验测得消耗KMnO4溶液的平均值为10.00mL,反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
2 5
0.02mol/L×0.010L n
n=0.0005mol,
与NaCN反应的过氧化氢物质的量=0.10mol/L×0.015L-0.0005mol=0.001mol
2CN-+5H2O2=N2+2CO2+6H2O
2 5
n(NaCN) 0.001mol
n(NaCN)=0.0004mol,
该废水NaCN的浓度=
=0.98g/L
故答案为:2H++2CN-+5H2O2=N2+2CO2+6H2O;0.98.
(1)NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,NaCN水解呈碱性的离子方程式为:CN-+H2O⇌HCN+OH-,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,在加水稀释,
故答案为:NaOH;
(2)流程中经过滤、洗涤、干燥后得到K4[Fe(CN)6].过滤实验中使用的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:漏斗;
(3)反应器中加入氯化钙,加入碳酸钠溶液可除去过量的Ca2+,
故答案为:除去其中的Ca2+;
(4)①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ/mol
依据盖斯定律计算(①+②)×
| 1 |
| 3 |
故答案为:Cu2S(s)+O2(g)=)=2Cu(s)+SO2(g)△H=-652.2KJ/mol;
(5)草酸(HOOCCOOH)在阴极上得电子生成OHCCOOH,阴极反应式为:HOOCCOOH+2H++2e-═OHCCOOH+H2O,
故答案为:HOOCCOOH+2H+OHCCOOH+H2O;
(6)取NaCN废液1L,浓缩到20mL,加入适量硫酸酸化得到的氰化氢与双氧水反应生成两种无毒气体为氮气和二氧化碳,反应的离子方程式为:2H++2CN-+5H2O2=N2+2CO2+6H2O,再用0.02mol/L的酸性KMnO4溶液滴定过程的H2O2,实验测得消耗KMnO4溶液的平均值为10.00mL,反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
2 5
0.02mol/L×0.010L n
n=0.0005mol,
与NaCN反应的过氧化氢物质的量=0.10mol/L×0.015L-0.0005mol=0.001mol
2CN-+5H2O2=N2+2CO2+6H2O
2 5
n(NaCN) 0.001mol
n(NaCN)=0.0004mol,
该废水NaCN的浓度=
| 0.0004mol×49g/mol |
| 0.020L |
故答案为:2H++2CN-+5H2O2=N2+2CO2+6H2O;0.98.
看了 亚铁氰化钾(K4Fe(CN)...的网友还看了以下:
(2014•德阳)A~J是初中化学中常见的物质,它们之间有如图所示的转化关系(部分反应条件已略去) 2020-06-12 …
氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下 2020-06-12 …
灰体(H)对黄体(h)为显性,将并联黄体雌果蝇(XhXhY)与正常灰体雄果蝇杂交,子代只产生了并联 2020-06-26 …
知识整合是巩固化学知识的一种重要手段,请看下面某同学的知识整合.已知A是一种白色固体,B和M均是黑 2020-07-20 …
已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃) 2020-11-01 …
选出下列词语中注音有误的一项:()A.翰hàn林白桦huà勒lè索莅lì临B.行háng伍黄鹂lí咱 2020-11-11 …
(2012•汕头二模)已知番茄植株有茸毛(D)对无茸毛(d)为显性,红果(H)对黄果(h)为显性,两 2020-11-12 …
已知番茄植株有茸毛(D)和无茸毛(d)为显形,红果(H)对黄果(h)为显形,基因型为DD的植株不能存 2020-12-25 …
有关物质的转化关系如图所示(部分物质和条件已略去),A是一种淡黄色粉末,B是某种矿物质中的主要成分, 2020-12-29 …
下表为黄山市和H地某月两天的日出日落时刻表(北京时间)。1.H地在黄山市的什么方向?A.东南方B.东 2021-01-22 …