早教吧作业答案频道 -->化学-->
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;②部
题目详情
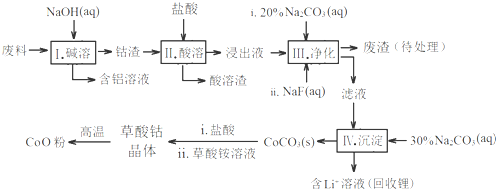
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是___.
(2)将步骤Ⅱ中Co2O3与盐酸反应的离子方程式补充完整(填化学式):Co2O3+6H++2Cl-=2___+___↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过___;废渣中的主要成分除了LiF外,还有___.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是___.[M (CoC2O4•2H2O)=183g/mol].

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是___.
(2)将步骤Ⅱ中Co2O3与盐酸反应的离子方程式补充完整(填化学式):Co2O3+6H++2Cl-=2___+___↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过___;废渣中的主要成分除了LiF外,还有___.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
▼优质解答
答案和解析
(1)步骤Ⅰ中得到含铝溶液是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式,钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
故答案为:Co2+;Cl2;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分除了LiF外还有Fe(OH)3;
故答案为:7.15;Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)计算晶体物质的量n=
=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150~210固体质量变化=5.49g-4.41g=1.08g,说明210°C失去结晶水得到CoC2O4,210~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
=0.02mol;n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,依据原子守恒配平书写反应的化学方程式为3CoC2O4+2O2
Co3O4+6CO2,故答案为:3CoC2O4+2O2
Co3O4+6CO2.
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式,钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
故答案为:Co2+;Cl2;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分除了LiF外还有Fe(OH)3;
故答案为:7.15;Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)计算晶体物质的量n=
| 5.49g |
| 183g/mol |
| 0.64g |
| 32g/mol |
| ||
| ||
看了 钴(Co)及其化合物在工业上...的网友还看了以下:
为了有效地完成学习任务,中学生需要制定学习计划,下面的选项中,不正确的是A.制定计划之前先要了解学 2020-05-16 …
泛素化降解泛素化途径降解蛋白质过程中,涉及哪几种酶 2020-05-17 …
以下自然现象的形成过程中,会吸热的是()A.冬季早上房屋上的霜B.初春,冰河解冻C.深夜时河边水面 2020-07-14 …
Ⅰ、电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与 2020-07-16 …
社会主义民主具有广泛性和真实性。其真实性表现在A.民主主体广泛B.民主权利广泛C.民主与专政相结合 2020-07-29 …
巴以矛盾导致中东地区长期动荡,引起国际社会广泛关注。当前在联合国框架下解决巴以矛盾的基本原则是()A 2020-11-08 …
matlab求解泛函微分方程数值解.我想用matlab求解一个泛函微分方程的数值解,编了个程序总是运 2020-11-17 …
英语成为使用最广泛语言的原因之一是英语成为使用最广泛语言的原因之一是[]A.英国人口多,人口增长快B 2020-11-22 …
下列句子没有语病的一项是()A.在如何提高课堂效率的问题上,老师听取了广泛同学们的意见B.专家表示, 2020-11-29 …
下列句子没有语病的一项是()A.在如何提高课堂效率的问题上,老师听取了同学们的广泛意见B.通过开通快 2020-12-05 …