早教吧作业答案频道 -->化学-->
氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法.I.电解处理法图1电源废水铁电极石墨电
题目详情
氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法.
I.电解处理法
图1电源废水铁电极石墨电极
用图1所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去.
(1)铁电极为___(填“阴极”或“阳极”),阳极产生ClO-的电极反应为___.
II.UV(紫外光线的简称)-H2O2氧化法.
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
(2)废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是___(用符号表示).
(3)K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应___.
(4)含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为___(a.7-10;b.10-11;c.11-13),解释选择该pH范围的原因___.
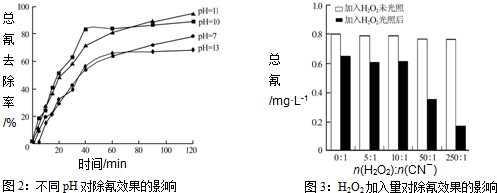
(5)图3表示某pH时,加入不同量H2O2,处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN-)=250:1时,剩余总氰为0.16mg•L-1,除氰率达80%,计算0-30min时间段反应速率v(CN-)=___mg•L-1min-1(结果保留两位有效数字).
I.电解处理法
图1电源废水铁电极石墨电极
用图1所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去.
(1)铁电极为___(填“阴极”或“阳极”),阳极产生ClO-的电极反应为___.

II.UV(紫外光线的简称)-H2O2氧化法.
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
(2)废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是___(用符号表示).
(3)K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应___.
(4)含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为___(a.7-10;b.10-11;c.11-13),解释选择该pH范围的原因___.

(5)图3表示某pH时,加入不同量H2O2,处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN-)=250:1时,剩余总氰为0.16mg•L-1,除氰率达80%,计算0-30min时间段反应速率v(CN-)=___mg•L-1min-1(结果保留两位有效数字).
▼优质解答
答案和解析
(1)废水中含CN-,控制溶液pH为9~10并加入NaCl,阳极产生的ClO-将CN-氧化,说明溶液中的氯离子在阳极失去电子发生氧化反应,电极反应为:2OH-+Cl--2e-═ClO-+H2O,阴极是氢离子得电子产生氢气,铁是活性电极,在装置中只能作阴极,不参加反应,
故答案为:阴极;2OH-+Cl--2e-═ClO-+H2O;
(2)根据离子反应方程式CN-+H2O2+H2O═A+NH3↑可知,N化合价为-3价,反应前后不改变,只能是双氧水将C从+2介氧化到+4价,根据电荷守恒和原子守恒,A应是带一个负电荷的阴离子,且包含1个C,1个H,3个O,即HCO3-,
故答案为:HCO3-;
(3)Fe(OH)3是弱碱,HCN是弱酸,则K3[Fe(CN)6]在中性溶液中有Fe3+和CN-发生微弱水解,即[Fe(CN)6]3-+3H2O⇌Fe(OH)3+3HCN+3CN-,
故答案为:[Fe(CN)6]3-+3H2O⇌Fe(OH)3+3HCN+3CN-;
(4)图2显示,PH在10-11时,除氰率超过80%,碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒),
故答案为:b;碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒);
(5)剩余总氰为0.16mg•L-1,除氰率达80%,则氰的总量为:0.16mg•L-1÷(1-80%)=0.80mg•L-1,
0-30分钟氰的改变量为:△c(CN-)=0.80mg•L-1×80%=0.64mg•L-1,v(CN-)=
=
=0.021mg•L-1min-1,
故答案为:0.021.
故答案为:阴极;2OH-+Cl--2e-═ClO-+H2O;
(2)根据离子反应方程式CN-+H2O2+H2O═A+NH3↑可知,N化合价为-3价,反应前后不改变,只能是双氧水将C从+2介氧化到+4价,根据电荷守恒和原子守恒,A应是带一个负电荷的阴离子,且包含1个C,1个H,3个O,即HCO3-,
故答案为:HCO3-;
(3)Fe(OH)3是弱碱,HCN是弱酸,则K3[Fe(CN)6]在中性溶液中有Fe3+和CN-发生微弱水解,即[Fe(CN)6]3-+3H2O⇌Fe(OH)3+3HCN+3CN-,
故答案为:[Fe(CN)6]3-+3H2O⇌Fe(OH)3+3HCN+3CN-;
(4)图2显示,PH在10-11时,除氰率超过80%,碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒),
故答案为:b;碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒);
(5)剩余总氰为0.16mg•L-1,除氰率达80%,则氰的总量为:0.16mg•L-1÷(1-80%)=0.80mg•L-1,
0-30分钟氰的改变量为:△c(CN-)=0.80mg•L-1×80%=0.64mg•L-1,v(CN-)=
| △c(CN-) |
| △t |
| 0.64mg/L |
| 30min |
故答案为:0.021.
看了 氰化物在冶金等行业应用广泛,...的网友还看了以下:
(2013•南宁一模)下列化学措施不可行的是()A.工业电解熔融Al203冶炼AlB.用浸有KMn 2020-05-13 …
对于金属冶炼的工业方法.下列有关说法中正确的是()A.可用电解饱和的MgCl2溶液的方法获得金属镁 2020-05-14 …
(2014•大兴区二模)金属在生产、生活中有广泛的用途.(1)铝能制成用于包装的铝箔,是由于铝具有 2020-05-14 …
我想问一下以前老的冶炼铜工艺(大约在上世纪20、30年代就开始冶炼),冶炼炉底剩下的铜渣,以前老的 2020-06-30 …
下列关于常见物质的工业冶炼说法正确的是A.工业制金属钠:电解饱和食盐水B.工业制溴:某些植物具有富 2020-07-10 …
除金、铂等极少数金属外,绝大多数金属元素以化合物形式存在于自然界中,将金属元素从其化合物中还原出来的 2020-11-01 …
汉代的冶铁技术处于世界前列。东汉的南阳太守杜诗曾发明利用水力鼓风冶铁的工具。这种工具是[]A.耧车B 2020-11-12 …
谁会这道题:汉代的冶铁技术处于世汉代的冶铁技术处于世界前列.东汉的南阳太守杜诗曾发明利用水力鼓风冶铁 2020-11-12 …
铜陵有色金属集团公司是电解铜产量全国第一的大型企业。其冶炼工艺中铜、硫回收率达到97%、87%。下图 2020-11-12 …
关于北京市工业的叙述,正确的是()A.海淀区集中了许多高新技术企业B.工业分布总的特点是比较均匀C. 2020-12-03 …