早教吧作业答案频道 -->化学-->
In是第5周期IIIA的元素;In2O3是一种透明的导电材料,可运用于触控屏、液晶显示器等高科技领域;利用水铟矿主要成分In(OH)3制备In2O3的工艺流程如下:(1)写出水铟矿被硫酸酸溶的离
题目详情
In是第5周期IIIA的元素;In2O3是一种透明的导电材料,可运用于触控屏、液晶显示器等高科技领域;利用水铟矿【主要成分In(OH)3制备In2O3的工艺流程如下:
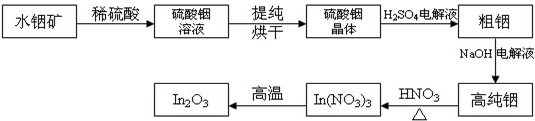
(1)写出水铟矿被硫酸酸溶的离子方程式:___.
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:___、___、过滤、洗涤和干燥.
(3)提纯粗铟的方法和铜的精炼原理相似,则粗铟为___(填“阴极”、“阳极”),写出阴极的电极反应式___.
(4)完成下列化学方程式:___In(NO3)3
___In2O3+___↑+___↑
(5)已知t℃时,反应In2O3+CO⇌2InO+CO2的平衡常数K=0.25;
i.t℃时,反应达到平衡时,n(CO):n(CO2)=___;
ii.在1L的密闭容器中加入0.02mol的In2O3(s),并通入xmol的CO,t℃时反应达到平衡.此时In2O3的转化率为50%,则x=___.
(6)高纯铟和浓硝酸反应过程中产生的NO2气体可以被Na2O2直接吸收,则标准状况下672mLNO2可以被___g Na2O2吸收.NO2的排放会引起一系列的环境问题,任写一条其引起的环境问题:___.

(1)写出水铟矿被硫酸酸溶的离子方程式:___.
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:___、___、过滤、洗涤和干燥.
(3)提纯粗铟的方法和铜的精炼原理相似,则粗铟为___(填“阴极”、“阳极”),写出阴极的电极反应式___.
(4)完成下列化学方程式:___In(NO3)3
| ||
(5)已知t℃时,反应In2O3+CO⇌2InO+CO2的平衡常数K=0.25;
i.t℃时,反应达到平衡时,n(CO):n(CO2)=___;
ii.在1L的密闭容器中加入0.02mol的In2O3(s),并通入xmol的CO,t℃时反应达到平衡.此时In2O3的转化率为50%,则x=___.
(6)高纯铟和浓硝酸反应过程中产生的NO2气体可以被Na2O2直接吸收,则标准状况下672mLNO2可以被___g Na2O2吸收.NO2的排放会引起一系列的环境问题,任写一条其引起的环境问题:___.
▼优质解答
答案和解析
将主要成分为In(OH)3的水铟矿溶解于稀硫酸,根据酸碱中和原理得到硫酸铟的溶液,将溶液蒸发浓缩、冷却结晶、过滤并洗涤、干燥得到硫酸铟晶体,将所得晶体与稀硫酸混合后电解可得到粗铟,再用NaOH溶液为电解液,进行粗铟精炼临到高纯铟,最后将高纯铟溶解于稀硝酸,并通过加热促进硝酸铟分解可得到In2O3;
(1)In(OH)3溶解于稀硫酸,发生反应的离子方程式为In(OH)3+3H+=In3++3H2O,故答案为:In(OH)3+3H+=In3++3H2O;
(2)从硫酸铟的溶液中获得硫酸铟晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤和干燥,故答案为:蒸发浓缩、冷却结晶;
(3)电解粗铟时,粗铟为阳极,阴极 In3+发生还原反应的电极反应为In3++3e-=In,故答案为:阳极;In3++3e-=In;
(4)硝酸铟受热易分解,产物为三氧化铟、二氧化氮及氧气,根据电子守恒和原子守恒可得此反应方程式,式:4In(NO3)3
2In2O3+12NO2↑+3O2↑,故答案为:4 2 12 NO2 3 O2;
(5)ⅰ.反应In2O3+CO⇌2InO+CO2的平衡常数K=
=0.25,根据同一容器中,气体的浓度比等于物质的量之比可知:n(CO):n(CO2)=4,故答案为:4;
ⅱ.0.02mol的In2O3(s)在反应达到平衡时转化率为50%,可知参加反应的In2O3物质量为0.01mol,同时参加反应的CO和生成的CO2的物质的量也为0.01mol,据ⅰ知平衡时n(CO):n(CO2)=4,即(x-0.01):0.01=4,解得x=0.05mol,故答案为:0.05mol;
(6)672mLNO2气体的物质的量为
=0.03mol,被nmolNa2O2直接吸收,则根据电子守恒:0.03mol×1=nmol×2,解得:n=0.015mol,Na2O2的质量为0.015mol×78g/mol=1.17g;大量NO2气体排到大气中,会造成光化学烟雾或硝酸型酸雨,故答案为:1.17;光化学烟雾或硝酸型酸雨.
(1)In(OH)3溶解于稀硫酸,发生反应的离子方程式为In(OH)3+3H+=In3++3H2O,故答案为:In(OH)3+3H+=In3++3H2O;
(2)从硫酸铟的溶液中获得硫酸铟晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤和干燥,故答案为:蒸发浓缩、冷却结晶;
(3)电解粗铟时,粗铟为阳极,阴极 In3+发生还原反应的电极反应为In3++3e-=In,故答案为:阳极;In3++3e-=In;
(4)硝酸铟受热易分解,产物为三氧化铟、二氧化氮及氧气,根据电子守恒和原子守恒可得此反应方程式,式:4In(NO3)3
| ||
(5)ⅰ.反应In2O3+CO⇌2InO+CO2的平衡常数K=
| c(CO2) |
| c(CO) |
ⅱ.0.02mol的In2O3(s)在反应达到平衡时转化率为50%,可知参加反应的In2O3物质量为0.01mol,同时参加反应的CO和生成的CO2的物质的量也为0.01mol,据ⅰ知平衡时n(CO):n(CO2)=4,即(x-0.01):0.01=4,解得x=0.05mol,故答案为:0.05mol;
(6)672mLNO2气体的物质的量为
| 0.672L |
| 22.4L/mol |
看了 In是第5周期IIIA的元素...的网友还看了以下:
下表是元素周期表的一部分,列出10种元素在元素周期表中的位置.用化学符号回答下列各问题:主族周期/ 2020-05-16 …
在电子商务中,电子钱包是指一种()。A.用于保存电子现金的电子文件B.所有电子货币的总称C.电子支付 2020-05-24 …
农民用某种杀虫剂消灭棉铃虫,开始使用时效果不错,但长期使用效果越来越差.造成这种情况最可能的原因是 2020-06-23 …
某农田长期使用一种农药,如图示该农田中某种甲虫群体密度变化曲线.下列叙述中不符合达尔文进化观点的是( 2020-11-02 …
下列有关菌种保藏的叙述中,错误的是()A.频繁使用的菌种,可用斜面培养基保藏在4℃的冰箱中B.临时保 2020-11-03 …
文献检索题想要查找某种期刊,可用以下哪些方法?文献检索4、想要查找某种期刊,可用以下哪些方法?A.基 2020-11-06 …
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑧七种元素在周期表中的位 2020-12-04 …
一个人长期服用同一种抗生素,到后期治疗效果就大大降低甚至完全无效.造成这样结果的原因是()A.病原菌 2020-12-20 …
一个人长期服用同一种抗生素,到后期治疗效果大大降低甚至无效.这是因为()A.病原菌不断产生各种变异( 2020-12-22 …
下列有关植物激素应用的叙述中,正确的是()A.用赤霉素处理大麦可简化啤酒的传统生产工艺B.乙烯可促进 2020-12-28 …