早教吧作业答案频道 -->化学-->
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).I.查阅资料(1)Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.(2)
题目详情
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
I. 查阅资料
(1)Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品常含有少量Na2SO3和Na2SO4.
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl.
II. 制备产品:实验装置如图所示(省略夹持装置):
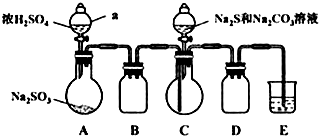
实验步骤:
(1)检查装置气密性,按图示加入试剂.
仪器a的名称是___;E中的试剂是___(选填下列字母编号).
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.
(3)等Na2S和Na2CO3完全消耗后,结束反应.过滤C中混合物,再将滤液
___(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品.
Ⅲ. 探究与反思:
(1)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,___,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4.
(2)为减少装置C中生成Na2SO4的量,该小组在不改变原有装置的基础上对上述某实验步骤进行了改进,改进后的操作是___如此操作的目的是___
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过___方法提纯.
I. 查阅资料
(1)Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品常含有少量Na2SO3和Na2SO4.
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl.
II. 制备产品:实验装置如图所示(省略夹持装置):

实验步骤:
(1)检查装置气密性,按图示加入试剂.
仪器a的名称是___;E中的试剂是___(选填下列字母编号).
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.
(3)等Na2S和Na2CO3完全消耗后,结束反应.过滤C中混合物,再将滤液
___(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品.
Ⅲ. 探究与反思:
(1)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,___,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4.
(2)为减少装置C中生成Na2SO4的量,该小组在不改变原有装置的基础上对上述某实验步骤进行了改进,改进后的操作是___如此操作的目的是___
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过___方法提纯.
▼优质解答
答案和解析
Ⅱ.(1)仪器a的名称是分液漏斗;E中的试剂是NaOH溶液,目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠溶液反应,与稀H2SO4和饱和NaHSO3溶液不反应,
故答案为:分液漏斗;B;
(3)将Na2S2O3结晶析出的操作应为:蒸发、结晶、过滤、洗涤、干燥,
故答案为:蒸发;
Ⅲ.【探究与反思】
(1)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,
故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸;
(2)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,防止Na2SO3被空气中的氧气氧化,
故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;防止Na2SO3被空气中的氧气氧化;
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯,
故答案为:重结晶.
故答案为:分液漏斗;B;
(3)将Na2S2O3结晶析出的操作应为:蒸发、结晶、过滤、洗涤、干燥,
故答案为:蒸发;
Ⅲ.【探究与反思】
(1)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,
故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸;
(2)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,防止Na2SO3被空气中的氧气氧化,
故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;防止Na2SO3被空气中的氧气氧化;
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯,
故答案为:重结晶.
看了 硫代硫酸钠是一种重要的化工产...的网友还看了以下:
在一定量硫酸铝和硫酸锌组成的混合物中硫酸根离子的物质的量共2mol,若铝离子和锌离子的物质的量之比 2020-04-27 …
用数字和化学符号表示1)2个氯原子2)3个碳酸根离子3)一个二氧化硫分子4)硫酸锌中硫元素显正六价 2020-05-14 …
可以除去面团发酵生成的酸的是?1碳酸钠 2硫酸铜 2020-05-14 …
a克铁加入到硫酸和硫酸铜组成的混合溶液中,反应后得到了a克的铜.则参加反应的硫酸铜与硫酸的物质的量 2020-05-17 …
某学习研究小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应制取五水硫酸铜混合酸的还原产物为NO 2020-06-25 …
现有硫酸铝和硫酸锌两种盐,试回答下列问题:1:0.5摩尔硫酸铝中所含的铝离子的个数是多少?2:1摩 2020-07-22 …
现有硫酸铝和硫酸锌两种盐,是回答下列问题:(1)0.5mol硫酸铝中所含铝离子的个数是多少?(2)1 2020-12-12 …
一般淡水的盐分主要是()1碳酸钠2硫酸盐3氯化钠4碳酸氢钙 2020-12-26 …
写出下列盐类水解反应的离子方程式:1碳酸钠2硫酸铝3氯化铵 2021-02-01 …
根据化合价写化学式9.氯化铵.10.氯化锌11.氯化镁12.氯化钾(2)硫酸盐(硫酸根显)1.硫酸钾 2021-02-18 …