早教吧作业答案频道 -->化学-->
碱式次氯酸镁[BMH化学式为Mg2ClO(OH)3•H2O]难溶于水,相对稳定,是一种有开发价值的无机抗菌剂.某研发小组通过下列流程制备碱式次氯酸镁:(1)在上述流程中,“过滤”操作用到的硅
题目详情
碱式次氯酸镁[BMH化学式为Mg2ClO(OH)3•H2O]难溶于水,相对稳定,是一种有开发价值的无机抗菌剂.某研发小组通过下列流程制备碱式次氯酸镁:
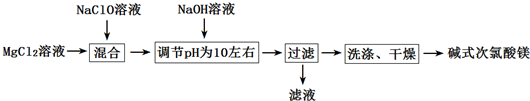
(1)在上述流程中,“过滤”操作用到的硅酸盐材质的仪器有___
(2)NaClO的电子式为___,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式___
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标.次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,则生成氯气的离子方程式为___
(4)就抗菌和杀菌效果而言,氯制剂具有广谱、高效的特点,像BMH这样难溶又稳定的氯制剂几乎别无他物.在酸性溶液中BMH具有杀菌、漂白作用的原因是___(用离子方程式表示)
(5)在混合溶液中加入NaOH溶液并调节pH在10左右,即生成BMH,其化学方程式为___.232

2

(1)在上述流程中,“过滤”操作用到的硅酸盐材质的仪器有___
(2)NaClO的电子式为___,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式___
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标.次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,则生成氯气的离子方程式为___
(4)就抗菌和杀菌效果而言,氯制剂具有广谱、高效的特点,像BMH这样难溶又稳定的氯制剂几乎别无他物.在酸性溶液中BMH具有杀菌、漂白作用的原因是___(用离子方程式表示)
(5)在混合溶液中加入NaOH溶液并调节pH在10左右,即生成BMH,其化学方程式为___.232

2
▼优质解答
答案和解析
氯化镁溶液与次氯酸钠溶液混合后,加入氢氧化钠溶液调节溶液pH,发生反应:2MgCl22+NaClO+3NaOH+H22O=Mg22ClO(OH)33•H22O↓+4NaCl,然后通过通过过滤、洗涤、干燥获得碱式次氯酸镁,
(1)过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(2)NaClO是离子化合物,由Na++离子和ClO--离子构成,NaClO的电子式为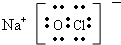 ;氯气与氢氧化钠溶液反应的离子方程式为:Cl22+2OH--=Cl--+ClO--+H22O,
;氯气与氢氧化钠溶液反应的离子方程式为:Cl22+2OH--=Cl--+ClO--+H22O,
故答案为: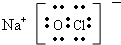 ;Cl22+2OH--=Cl--+ClO--+H22O;
;Cl22+2OH--=Cl--+ClO--+H22O;
(3)次氯酸盐与盐酸反应所生成的氯气,反应的离子方程式为:Cl--+ClO--+2H++=Cl22↑+H22O,
故答案为:Cl--+ClO--+2H++=Cl22↑+H22O;
(4)Mg22ClO(OH)33•H22O在酸性条件下发生反应:Mg22ClO(OH)33•H22O+4H++=2Mg2+2++HClO+4H22O,反应生成的次氯酸具有强氧化性,所以在酸性溶液中BMH具有杀菌、漂白作用,
故答案为:Mg22ClO(OH)33•H22O+4H++=2Mg2+2++HClO+4H22O;
(5)在混合溶液中加入NaOH溶液并调节pH在10左右,即生成BMH,反应的化学方程式为:2MgCl22+NaClO+3NaOH+H22O=Mg22ClO(OH)33•H22O↓+4NaCl,
故答案为:2MgCl22+NaClO+3NaOH+H22O=Mg22ClO(OH)33•H22O↓+4NaCl.
(1)过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(2)NaClO是离子化合物,由Na++离子和ClO--离子构成,NaClO的电子式为
 ;氯气与氢氧化钠溶液反应的离子方程式为:Cl22+2OH--=Cl--+ClO--+H22O,
;氯气与氢氧化钠溶液反应的离子方程式为:Cl22+2OH--=Cl--+ClO--+H22O,故答案为:
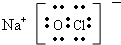 ;Cl22+2OH--=Cl--+ClO--+H22O;
;Cl22+2OH--=Cl--+ClO--+H22O;(3)次氯酸盐与盐酸反应所生成的氯气,反应的离子方程式为:Cl--+ClO--+2H++=Cl22↑+H22O,
故答案为:Cl--+ClO--+2H++=Cl22↑+H22O;
(4)Mg22ClO(OH)33•H22O在酸性条件下发生反应:Mg22ClO(OH)33•H22O+4H++=2Mg2+2++HClO+4H22O,反应生成的次氯酸具有强氧化性,所以在酸性溶液中BMH具有杀菌、漂白作用,
故答案为:Mg22ClO(OH)33•H22O+4H++=2Mg2+2++HClO+4H22O;
(5)在混合溶液中加入NaOH溶液并调节pH在10左右,即生成BMH,反应的化学方程式为:2MgCl22+NaClO+3NaOH+H22O=Mg22ClO(OH)33•H22O↓+4NaCl,
故答案为:2MgCl22+NaClO+3NaOH+H22O=Mg22ClO(OH)33•H22O↓+4NaCl.
看了 碱式次氯酸镁[BMH化学式为...的网友还看了以下:
某学生为了将氯化钠和氯化钙两种固体混合物分离,设计了下列实验方案:试回答下列问题:(1)加入过量N 2020-05-02 …
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100m 2020-05-13 …
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+.取该溶液100mL,加入过 2020-05-13 …
.向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,在充分反映后过滤.以下判断错误的是A 滤纸上的 2020-05-17 …
粗盐中含有钙离子、硫酸根离子和泥沙等杂质,实验室中粗盐提纯的操作步骤如下:(1)将粗盐研细,加水使 2020-06-19 …
我140*30*30的缸用底滤管和上滤底下铺了一层珊瑚砂上面一层黑工沙放了8块10CM大小的珊瑚石 2020-06-20 …
很难想象城市污水不经过处理我们的生活会变成什么样。若污水经过污水处理厂的“污水处理池”过滤一次,能 2020-06-23 …
A~H以及X、Y的转化关系如右图所示:请回答下列问题:(1)电解上述滤液时产生G的电极是,其电极反应 2021-01-24 …
A~H以及X、Y的转化关系如右图所示:请回答下列问题:(1)电解上述滤液时产生G的电极是,其电极反应 2021-01-24 …
将一定质量的锌粉加入到硝酸铜和硝酸银的混合溶液中,充分反应后过滤.下列分析正确的是A、滤渣中一定有铜 2021-02-18 …