早教吧作业答案频道 -->化学-->
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
题目详情
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol.由上述方程式可知,CH3OH(g)的燃烧热___(填“大于”、“等于”或小于”)192.9kJ/mol.已知水的气化热为44kJ/mol,则表示氢气燃烧热的热化学方程式为___.
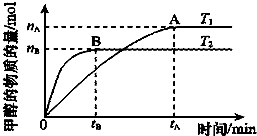
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃),该反应为___反应(填“放热”或“吸热”);在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为___.

322232223
22121222

(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol.由上述方程式可知,CH3OH(g)的燃烧热___(填“大于”、“等于”或小于”)192.9kJ/mol.已知水的气化热为44kJ/mol,则表示氢气燃烧热的热化学方程式为___.
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃),该反应为___反应(填“放热”或“吸热”);在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为___.

322232223
22121222
▼优质解答
答案和解析
(1)表示甲醇燃烧热,应是去mol甲醇燃烧生成二氧化碳与液态水,由于气态水的能量比较液态水的能量高,故生成液态水放出的热量更多,故CH33OH(g)的燃烧热大于192.9kJ/mol,
已知:①CH33OH(g)+H22O(g)=CO22(g)+3H22(g)△H=+49.0kJ/mol
②CH33OH(g)+
O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol.
水的气化热为44kJ/mol,可得:
③H2O(l)=H2O(g)△H=+44kJ/mol
根据盖斯定律,(②-①÷3)-③可得:H2(g)+
O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:大于;H2(g)+
O2(g)=H2O(l)△H=-124.6kJ/mol;
(2)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为a,转化的二氧化碳为amol,则:
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
3 2 3 3 32 2 2O22(g)=CO22(g)+2H22O(g)△H=-192.9kJ/mol.
水的气化热为44kJ/mol,可得:
③H22O(l)=H22O(g)△H=+44kJ/mol
根据盖斯定律,(②-①÷3)-③可得:H22(g)+
O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:大于;H2(g)+
O2(g)=H2O(l)△H=-124.6kJ/mol;
(2)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为a,转化的二氧化碳为amol,则:
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
1 2 1 1 12 2 2O22(g)=H22O(l)△H=-124.6kJ/mol,
故答案为:大于;H22(g)+
O2(g)=H2O(l)△H=-124.6kJ/mol;
(2)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为a,转化的二氧化碳为amol,则:
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
1 2 1 1 12 2 2O22(g)=H22O(l)△H=-124.6kJ/mol;
(2)温度T22先达到平衡,则温度T22>T11,又温度高时平衡状态CH33OH的物质的量少,则说明升高温度,可逆反应CO22+3H22⇌CH33OH+H22O向逆反应方向移动,故正反应为放热反应;
CO22转化率为a,转化的二氧化碳为amol,则:
CO22 (g)+3H22(g)=CH33OH(g)+H22O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
已知:①CH33OH(g)+H22O(g)=CO22(g)+3H22(g)△H=+49.0kJ/mol
②CH33OH(g)+
| 3 |
| 2 |
水的气化热为44kJ/mol,可得:
③H2O(l)=H2O(g)△H=+44kJ/mol
根据盖斯定律,(②-①÷3)-③可得:H2(g)+
| 1 |
| 2 |
故答案为:大于;H2(g)+
| 1 |
| 2 |
(2)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为a,转化的二氧化碳为amol,则:
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
| 3 |
| 2 |
水的气化热为44kJ/mol,可得:
③H22O(l)=H22O(g)△H=+44kJ/mol
根据盖斯定律,(②-①÷3)-③可得:H22(g)+
| 1 |
| 2 |
故答案为:大于;H2(g)+
| 1 |
| 2 |
(2)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为a,转化的二氧化碳为amol,则:
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
| 1 |
| 2 |
故答案为:大于;H22(g)+
| 1 |
| 2 |
(2)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为a,转化的二氧化碳为amol,则:
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
| 1 |
| 2 |
(2)温度T22先达到平衡,则温度T22>T11,又温度高时平衡状态CH33OH的物质的量少,则说明升高温度,可逆反应CO22+3H22⇌CH33OH+H22O向逆反应方向移动,故正反应为放热反应;
CO22转化率为a,转化的二氧化碳为amol,则:
CO22 (g)+3H22(g)=CH33OH(g)+H22O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
看了 科学家利用太阳能分解水生成的...的网友还看了以下:
已知:乙醇可被强氧化剂氧化为乙酸,CH2BrCH=CHCH2Br,经三步制取HOOCH(Cl)CH 2020-05-12 …
Fe+2Hcl=Fecl2+H求氧化剂和还原剂的质量之比,氧化产物和还原产物的物质的量之比,氧化产 2020-07-13 …
氯化铝(AlCl3)是一种净水剂.小婷同学测得氯化铝溶液显酸性,下列有关说法不正确的是()A.氯化 2020-07-16 …
(2012·广安)“塑化剂”是一种重要的化工原料,属2B类致癌物,曾被添加到食品中,造成了“塑化剂” 2020-11-12 …
(2013•梧州一模)“塑化剂”是一种重要的工业原料,但被不法商人添加到食品中,造成了“塑化剂”风波 2020-11-13 …
“塑化剂”是一种重要的工业原料,但被不法商人添加到商品中,造成了“塑化剂风波”.已知“塑化剂”的化学 2020-12-15 …
“塑化剂”是一种重要的工业原料,但被不法商人添加到食品中,造成了“塑化剂”风波。已知“塑化剂”的化学 2020-12-15 …
给患者一次静脉注射4000mg药剂,已知药,球物在体内的代谢速率与当时所含药量成正比(比例常数R=0 2020-12-22 …
(14分)汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气: 2021-01-12 …
(2十如2•保山)“塑化剂”是一种重要7工业原料,但被不法商人添加到商品中,造成了“塑化剂风波”.已 2021-01-14 …