早教吧作业答案频道 -->化学-->
烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点.(1)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3)选择性地与NOx
题目详情
烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点.
(1)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O.
①已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.5kJ•mol-1
N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)△H=___
②在催化剂作用下,尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O.写出CO(NH2)2与NO2反应的化学方程式___.
(2)催化剂V2O5可用于处理NOx、SO2.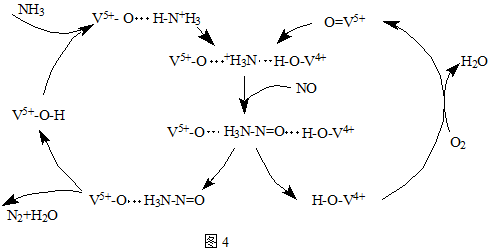
①图1是一种用NH3脱除烟气中NO的原理.当消耗a mol NH3和b mol O2时,消耗NO的物质的量为___.
②V2O5在催化降解NOx的过程中,也会对SO2的氧化起到一定的催化作用,其反应式如下:
a. V2O5+SO2=V2O4+SO3
b.___
c. 2VOSO4=V2O5+SO2+SO3
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.n(NH3):n(SO3)对硫酸氢铵及硫酸铵形成的影响如图5所示,图5中A、C区域代表的物质分别为___,___.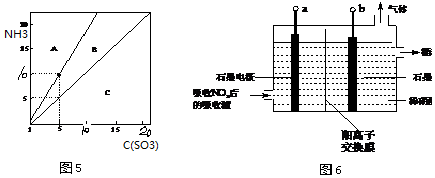
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸.电解装置如图3所示.阳极的电极反应式为___.
②O3也可用于烟气脱硝.O3氧化NO2的氧化产物为___.x2
3x22
322-1
22-1
3222
22x22222
25x2
332
25x2
252243
42523
333
x2-4
332
(1)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O.
①已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.5kJ•mol-1
N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)△H=___
②在催化剂作用下,尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O.写出CO(NH2)2与NO2反应的化学方程式___.
(2)催化剂V2O5可用于处理NOx、SO2.

①图1是一种用NH3脱除烟气中NO的原理.当消耗a mol NH3和b mol O2时,消耗NO的物质的量为___.
②V2O5在催化降解NOx的过程中,也会对SO2的氧化起到一定的催化作用,其反应式如下:
a. V2O5+SO2=V2O4+SO3
b.___
c. 2VOSO4=V2O5+SO2+SO3
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.n(NH3):n(SO3)对硫酸氢铵及硫酸铵形成的影响如图5所示,图5中A、C区域代表的物质分别为___,___.

(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸.电解装置如图3所示.阳极的电极反应式为___.
②O3也可用于烟气脱硝.O3氧化NO2的氧化产物为___.x2
3x22
322-1
22-1
3222
22x22222
25x2

332
25x2
252243
42523
333

x2-4
332
▼优质解答
答案和解析
(1)①已知:4NH33(g)+5O22(g)⇌4NO(g)+6H22O(g)△H=-905.5kJ•mol-1-1①
N22(g)+O22(g)⇌2NO(g)△H=+180kJ•mol-1-1②,
根据盖斯定律①-②×2可得:4NH33(g)+4NO(g)+O22(g)⇌4N2(g)+6H22O(g)△H=(-905.5kJ•mol-1-1)-(+180kJ•mol-1-1)×2=-1625.5kJ/mol;
故答案为:-1625.5kJ/mol;
②据原子守恒和电子守恒,可以写为:4CO(NH22)22+6NO22═7N22+4CO22+8H22O,
故答案为:4CO(NH22)22+6NO22═7N22+4CO22+8H22O;
(2)①氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH33转化为N22失去6mol电子,amolNH33反应失去电子3amol,1mol O22得到4mol电子,bmolO22反应得到电子4bmol,则NO转化为N22得到的电子为
mol,
故答案为:
mol;
②V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO4,VOSO4 分解生成V2O5、SO2、SO3,
该催化循环机理的化学方程式为:
SO2+V2O5═SO3+V2O4,
2SO2+O2+V2O4=2VOSO4,
2VOSO4=V2O5+SO2+SO3,
故答案为:2SO2+O2+V2O4=2VOSO4;
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.分析n(NH3):n(SO3)对硫酸氢铵及硫酸铵形成的影响可知,三氧化硫越多生成产物为硫酸氢氨,氨气越多生成的产物为硫酸铵,则图5中A、C区域代表的物质分别为(NH4)2SO4,NH4HSO4;,
故答案为:(NH4)2SO4,NH4HSO4;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H2O+HNO2-2e-=3H++NO3-,
故答案为:H2O+HNO2-2e-=3H++NO3-;
②O3也可用于烟气脱硝.二氧化氮中氮元素化合价+4价,O3氧化NO2的氧化产物为+5价氮的化合物为N2O5,故答案为:N2O5 .
3a-4b 2 3a-4b 3a-4b 3a-4b2 2 2mol,
故答案为:
mol;
②V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO4,VOSO4 分解生成V2O5、SO2、SO3,
该催化循环机理的化学方程式为:
SO2+V2O5═SO3+V2O4,
2SO2+O2+V2O4=2VOSO4,
2VOSO4=V2O5+SO2+SO3,
故答案为:2SO2+O2+V2O4=2VOSO4;
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.分析n(NH3):n(SO3)对硫酸氢铵及硫酸铵形成的影响可知,三氧化硫越多生成产物为硫酸氢氨,氨气越多生成的产物为硫酸铵,则图5中A、C区域代表的物质分别为(NH4)2SO4,NH4HSO4;,
故答案为:(NH4)2SO4,NH4HSO4;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H2O+HNO2-2e-=3H++NO3-,
故答案为:H2O+HNO2-2e-=3H++NO3-;
②O3也可用于烟气脱硝.二氧化氮中氮元素化合价+4价,O3氧化NO2的氧化产物为+5价氮的化合物为N2O5,故答案为:N2O5 .
3a-4b 2 3a-4b 3a-4b 3a-4b2 2 2mol;
②V22O55氧化SO22时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO44,VOSO44 分解生成V22O55、SO22、SO33,
该催化循环机理的化学方程式为:
SO22+V22O55═SO33+V22O44,
2SO22+O22+V22O44=2VOSO44,
2VOSO44=V22O55+SO22+SO33,
故答案为:2SO22+O22+V22O44=2VOSO44;
③SO33进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.分析n(NH33):n(SO33)对硫酸氢铵及硫酸铵形成的影响可知,三氧化硫越多生成产物为硫酸氢氨,氨气越多生成的产物为硫酸铵,则图5中A、C区域代表的物质分别为(NH44)22SO44,NH44HSO44;,
故答案为:(NH44)22SO44,NH44HSO44;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOxx生成亚硝酸[Ka(HNO22)=5.1×10-4-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H22O+HNO22-2e--=3H+++NO33--,
故答案为:H22O+HNO22-2e--=3H+++NO33--;
②O33也可用于烟气脱硝.二氧化氮中氮元素化合价+4价,O33氧化NO22的氧化产物为+5价氮的化合物为N22O55,故答案为:N22O5 5 .
N22(g)+O22(g)⇌2NO(g)△H=+180kJ•mol-1-1②,
根据盖斯定律①-②×2可得:4NH33(g)+4NO(g)+O22(g)⇌4N2(g)+6H22O(g)△H=(-905.5kJ•mol-1-1)-(+180kJ•mol-1-1)×2=-1625.5kJ/mol;
故答案为:-1625.5kJ/mol;
②据原子守恒和电子守恒,可以写为:4CO(NH22)22+6NO22═7N22+4CO22+8H22O,
故答案为:4CO(NH22)22+6NO22═7N22+4CO22+8H22O;
(2)①氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH33转化为N22失去6mol电子,amolNH33反应失去电子3amol,1mol O22得到4mol电子,bmolO22反应得到电子4bmol,则NO转化为N22得到的电子为
| 3a-4b |
| 2 |
故答案为:
| 3a-4b |
| 2 |
②V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO4,VOSO4 分解生成V2O5、SO2、SO3,
该催化循环机理的化学方程式为:
SO2+V2O5═SO3+V2O4,
2SO2+O2+V2O4=2VOSO4,
2VOSO4=V2O5+SO2+SO3,
故答案为:2SO2+O2+V2O4=2VOSO4;
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.分析n(NH3):n(SO3)对硫酸氢铵及硫酸铵形成的影响可知,三氧化硫越多生成产物为硫酸氢氨,氨气越多生成的产物为硫酸铵,则图5中A、C区域代表的物质分别为(NH4)2SO4,NH4HSO4;,
故答案为:(NH4)2SO4,NH4HSO4;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H2O+HNO2-2e-=3H++NO3-,
故答案为:H2O+HNO2-2e-=3H++NO3-;
②O3也可用于烟气脱硝.二氧化氮中氮元素化合价+4价,O3氧化NO2的氧化产物为+5价氮的化合物为N2O5,故答案为:N2O5 .
| 3a-4b |
| 2 |
故答案为:
| 3a-4b |
| 2 |
②V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO4,VOSO4 分解生成V2O5、SO2、SO3,
该催化循环机理的化学方程式为:
SO2+V2O5═SO3+V2O4,
2SO2+O2+V2O4=2VOSO4,
2VOSO4=V2O5+SO2+SO3,
故答案为:2SO2+O2+V2O4=2VOSO4;
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.分析n(NH3):n(SO3)对硫酸氢铵及硫酸铵形成的影响可知,三氧化硫越多生成产物为硫酸氢氨,氨气越多生成的产物为硫酸铵,则图5中A、C区域代表的物质分别为(NH4)2SO4,NH4HSO4;,
故答案为:(NH4)2SO4,NH4HSO4;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H2O+HNO2-2e-=3H++NO3-,
故答案为:H2O+HNO2-2e-=3H++NO3-;
②O3也可用于烟气脱硝.二氧化氮中氮元素化合价+4价,O3氧化NO2的氧化产物为+5价氮的化合物为N2O5,故答案为:N2O5 .
| 3a-4b |
| 2 |
②V22O55氧化SO22时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO44,VOSO44 分解生成V22O55、SO22、SO33,
该催化循环机理的化学方程式为:
SO22+V22O55═SO33+V22O44,
2SO22+O22+V22O44=2VOSO44,
2VOSO44=V22O55+SO22+SO33,
故答案为:2SO22+O22+V22O44=2VOSO44;
③SO33进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.分析n(NH33):n(SO33)对硫酸氢铵及硫酸铵形成的影响可知,三氧化硫越多生成产物为硫酸氢氨,氨气越多生成的产物为硫酸铵,则图5中A、C区域代表的物质分别为(NH44)22SO44,NH44HSO44;,
故答案为:(NH44)22SO44,NH44HSO44;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOxx生成亚硝酸[Ka(HNO22)=5.1×10-4-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H22O+HNO22-2e--=3H+++NO33--,
故答案为:H22O+HNO22-2e--=3H+++NO33--;
②O33也可用于烟气脱硝.二氧化氮中氮元素化合价+4价,O33氧化NO22的氧化产物为+5价氮的化合物为N22O55,故答案为:N22O5 5 .
看了 烟气的脱硝(除NOx)技术和...的网友还看了以下:
烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点.(1)选择性催化还原技术( 2020-04-11 …
脱硝通常指将烟气中的氮氧化物(NOx)转化为无害的物质.(1)选择性催化还原技术(SCR)是目前最 2020-05-16 …
研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮 2020-06-09 …
SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放.(1)SCR(选择性催化还原) 2020-06-11 …
(2014•浙江)下列说法不正确的是()A.光催化还原水制氢比电解水制氢更节能环保、更经济B.氨氮 2020-07-20 …
(16分)雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除 2020-07-25 …
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.(1)工业尾气中含有大量的氮氧化物, 2020-11-07 …
NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如左图;研究发现在以Fe2O3为主的催化 2020-11-20 …
随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题.(1)NH3催化还原氮氧化物 2020-12-24 …
选择性催化还原法(SCR)烟气脱硝技术是一种成熟的NOx控制处理方法.这种方法是指在有氧条件下且合适 2021-02-16 …