早教吧作业答案频道 -->化学-->
NH3和NOx在催化剂作用下可转变为N2和H2O,这是目前硝酸厂尾气治理所普遍采用的一种方法,为了提高NO的转化率实际操作中用过量的氨气.某研究小组拟验证NO能被氨气还原并计算其转化率.
题目详情
NH3和NOx在催化剂作用下可转变为N2和H2O,这是目前硝酸厂尾气治理所普遍采用的一种方法,为了提高NO的转化率实际操作中用过量的氨气.某研究小组拟验证NO能被氨气还原并计算其转化率.(已知:浓硫酸在常温下不氧化NO气体).
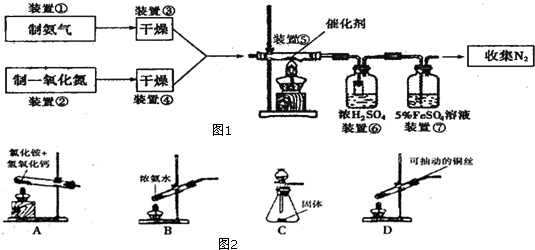
(1)装置③可以选的干燥剂为:___(选填序号,下同);
a.浓硫酸 b.碱石灰 c.无水氯化钙
(2)若实验室只提供浓氨水和生石灰两种试剂,你会选择图2___装置来制取氨气;所选装置中盛放生石灰的仪器名称是___.
(3)写出装置⑤中反应的化学方程式___;该反应中的氧化剂是___.
(4)实验室在用装置D制取较纯NO过程中,先在试管中加入2~3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用___.
(5)实验完成后,检验装置⑥中NH4+的存在需要浓NaOH溶液和___试纸.
(6)已知NO与FeSO4溶液反应形成棕色可溶性的[Fe(NO)]SO4,装置⑥中,没有将进气导管直接插入浓硫酸中,而是接了一小段玻璃管,小段玻璃管的作用是___;装置⑦的作用是除去NO和检验氨气是否除尽,若氨气未除尽观察到⑦中的实验现象是___.
(7)化学是一门以实验为基础的科学,下列叙述正确的是___(填写序号).
①将0.2mol•L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液.
③用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管.
④托盘天平、容量瓶、量筒、滴定管等定量仪器均标有0刻度线.
⑤除去CO2中HCl,可将混合气体通过盛有饱和Na2CO3溶液的洗气瓶.
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾.
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-.NH3和NOx在催化剂作用下可转变为N2和H2O,这是目前硝酸厂尾气治理所普遍采用的一种方法,为了提高NO的转化率实际操作中用过量的氨气.某研究小组拟验证NO能被氨气还原并计算其转化率.(已知:浓硫酸在常温下不氧化NO气体).

(1)装置③可以选的干燥剂为:___(选填序号,下同);
a.浓硫酸 b.碱石灰 c.无水氯化钙
(2)若实验室只提供浓氨水和生石灰两种试剂,你会选择图2___装置来制取氨气;所选装置中盛放生石灰的仪器名称是___.
(3)写出装置⑤中反应的化学方程式___;该反应中的氧化剂是___.
(4)实验室在用装置D制取较纯NO过程中,先在试管中加入2~3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用___.
(5)实验完成后,检验装置⑥中NH4+的存在需要浓NaOH溶液和___试纸.
(6)已知NO与FeSO4溶液反应形成棕色可溶性的[Fe(NO)]SO4,装置⑥中,没有将进气导管直接插入浓硫酸中,而是接了一小段玻璃管,小段玻璃管的作用是___;装置⑦的作用是除去NO和检验氨气是否除尽,若氨气未除尽观察到⑦中的实验现象是___.
(7)化学是一门以实验为基础的科学,下列叙述正确的是___(填写序号).
①将0.2mol•L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液.
③用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管.
④托盘天平、容量瓶、量筒、滴定管等定量仪器均标有0刻度线.
⑤除去CO2中HCl,可将混合气体通过盛有饱和Na2CO3溶液的洗气瓶.
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾.
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-.3x22

4+
44
-13
223
32-

(1)装置③可以选的干燥剂为:___(选填序号,下同);
a.浓硫酸 b.碱石灰 c.无水氯化钙
(2)若实验室只提供浓氨水和生石灰两种试剂,你会选择图2___装置来制取氨气;所选装置中盛放生石灰的仪器名称是___.
(3)写出装置⑤中反应的化学方程式___;该反应中的氧化剂是___.
(4)实验室在用装置D制取较纯NO过程中,先在试管中加入2~3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用___.
(5)实验完成后,检验装置⑥中NH4+的存在需要浓NaOH溶液和___试纸.
(6)已知NO与FeSO4溶液反应形成棕色可溶性的[Fe(NO)]SO4,装置⑥中,没有将进气导管直接插入浓硫酸中,而是接了一小段玻璃管,小段玻璃管的作用是___;装置⑦的作用是除去NO和检验氨气是否除尽,若氨气未除尽观察到⑦中的实验现象是___.
(7)化学是一门以实验为基础的科学,下列叙述正确的是___(填写序号).
①将0.2mol•L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液.
③用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管.
④托盘天平、容量瓶、量筒、滴定管等定量仪器均标有0刻度线.
⑤除去CO2中HCl,可将混合气体通过盛有饱和Na2CO3溶液的洗气瓶.
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾.
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-.NH3和NOx在催化剂作用下可转变为N2和H2O,这是目前硝酸厂尾气治理所普遍采用的一种方法,为了提高NO的转化率实际操作中用过量的氨气.某研究小组拟验证NO能被氨气还原并计算其转化率.(已知:浓硫酸在常温下不氧化NO气体).

(1)装置③可以选的干燥剂为:___(选填序号,下同);
a.浓硫酸 b.碱石灰 c.无水氯化钙
(2)若实验室只提供浓氨水和生石灰两种试剂,你会选择图2___装置来制取氨气;所选装置中盛放生石灰的仪器名称是___.
(3)写出装置⑤中反应的化学方程式___;该反应中的氧化剂是___.
(4)实验室在用装置D制取较纯NO过程中,先在试管中加入2~3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用___.
(5)实验完成后,检验装置⑥中NH4+的存在需要浓NaOH溶液和___试纸.
(6)已知NO与FeSO4溶液反应形成棕色可溶性的[Fe(NO)]SO4,装置⑥中,没有将进气导管直接插入浓硫酸中,而是接了一小段玻璃管,小段玻璃管的作用是___;装置⑦的作用是除去NO和检验氨气是否除尽,若氨气未除尽观察到⑦中的实验现象是___.
(7)化学是一门以实验为基础的科学,下列叙述正确的是___(填写序号).
①将0.2mol•L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液.
③用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管.
④托盘天平、容量瓶、量筒、滴定管等定量仪器均标有0刻度线.
⑤除去CO2中HCl,可将混合气体通过盛有饱和Na2CO3溶液的洗气瓶.
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾.
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-.3x22

4+
44
-13
223
32-
▼优质解答
答案和解析
(1)装置③干燥氨气选择和氨气不反应、不能溶解氨气的干燥剂;
a.浓硫酸和氨气反应,不能干燥氨气,故a不符合;
b.碱石灰是碱性干燥剂,可以干燥氨气,故b符合;
c.无水氯化钙会和氨气结合不能干燥氨气,故c不符合;
故答案为:b;
(2)浓氨水和生石灰两种试剂制备氨气,可以利用浓氨水滴入生石灰中溶解放热一水合氨分解生成氨气,也可以加热氨水生成氨气,反应的化学方程式为:NH33•H22O
NH3↑+H2O或NH3•H2O
NH3↑+H2O,则可以选择装置B或C,C装置中盛放生石灰的仪器名称是锥形瓶,
故答案为:B或C;锥形瓶;
(3)在加热和催化剂条件下,NO与氨气反应生成氮气和水,其反应的方程式为:6NO+4NH3
5N2+6H2O;反应中NO中的N元素得电子化合价降低,则NO为氧化剂;
故答案为:6NO+4NH3
5N2+6H2O;NO;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
CaO CaO CaO CaO NH33↑+H22O或NH33•H22O
NH3↑+H2O,则可以选择装置B或C,C装置中盛放生石灰的仪器名称是锥形瓶,
故答案为:B或C;锥形瓶;
(3)在加热和催化剂条件下,NO与氨气反应生成氮气和水,其反应的方程式为:6NO+4NH3
5N2+6H2O;反应中NO中的N元素得电子化合价降低,则NO为氧化剂;
故答案为:6NO+4NH3
5N2+6H2O;NO;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
△ △ △ △ NH33↑+H22O,则可以选择装置B或C,C装置中盛放生石灰的仪器名称是锥形瓶,
故答案为:B或C;锥形瓶;
(3)在加热和催化剂条件下,NO与氨气反应生成氮气和水,其反应的方程式为:6NO+4NH33
5N2+6H2O;反应中NO中的N元素得电子化合价降低,则NO为氧化剂;
故答案为:6NO+4NH3
5N2+6H2O;NO;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
△
催化剂 催化剂 催化剂 催化剂△ △ △5N22+6H22O;反应中NO中的N元素得电子化合价降低,则NO为氧化剂;
故答案为:6NO+4NH33
5N2+6H2O;NO;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
△
催化剂 催化剂 催化剂 催化剂△ △ △5N22+6H22O;NO;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO22、HCl都能和饱和Na22CO33溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO332-2-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
a.浓硫酸和氨气反应,不能干燥氨气,故a不符合;
b.碱石灰是碱性干燥剂,可以干燥氨气,故b符合;
c.无水氯化钙会和氨气结合不能干燥氨气,故c不符合;
故答案为:b;
(2)浓氨水和生石灰两种试剂制备氨气,可以利用浓氨水滴入生石灰中溶解放热一水合氨分解生成氨气,也可以加热氨水生成氨气,反应的化学方程式为:NH33•H22O
| ||
| ||
故答案为:B或C;锥形瓶;
(3)在加热和催化剂条件下,NO与氨气反应生成氮气和水,其反应的方程式为:6NO+4NH3
| ||
| △ |
故答案为:6NO+4NH3
| ||
| △ |
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
| ||
| CaO |
. |
| CaO |
. |
| CaO |
. |
| CaO |
. |
.
.
.
.
.
| ||
故答案为:B或C;锥形瓶;
(3)在加热和催化剂条件下,NO与氨气反应生成氮气和水,其反应的方程式为:6NO+4NH3
| ||
| △ |
故答案为:6NO+4NH3
| ||
| △ |
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.故答案为:B或C;锥形瓶;
(3)在加热和催化剂条件下,NO与氨气反应生成氮气和水,其反应的方程式为:6NO+4NH33
| ||
| △ |
故答案为:6NO+4NH3
| ||
| △ |
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
| ||
| △ |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.故答案为:6NO+4NH33
| ||
| △ |
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
| ||
| △ |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO22、HCl都能和饱和Na22CO33溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO332-2-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
看了 NH3和NOx在催化剂作用下...的网友还看了以下:
英语翻译主要是想问关于事态的事.一般来说主将从现,但是用虚拟语气的话,是主句虚拟,从句虚拟还是都虚 2020-04-08 …
关于虚拟语气问题如何判断虚拟语气.如何辨别这个句子是属于与现在事实相反,与过去事实相反,还是与将来 2020-04-27 …
求英语高手帮忙造句……用Wish造句,要用上虚拟语气2句用wouldrather造句,同要用虚拟语 2020-06-02 …
虚拟语气IfIshoulddie为什么不主将从现?IfIshoulddie,youshouldge 2020-06-05 …
虚拟语气表现在和将来,如何区分IfIhadtime,Iwouldgothere.虚拟语气里面,与现 2020-06-06 …
虚拟语气中将来事实相反的条件句的用法,和不用虚拟语气有何不同Ifheshouldnotcometo 2020-06-06 …
关于虚拟语气的问题.虚拟语气的条件句全称叫做虚拟语气的条件状语从句?那为什么恰好是状语从句不是别的 2020-06-07 …
麻烦大家了后缀是为al是什么词是名词?还什么?还有个问题就是虚拟语气中怎么知道是这个句子是与过去事 2020-06-21 …
速求大家帮我看看这个虚拟语气怎么用形式是if+haddone,主语+wouldhavedone.这 2020-07-20 …
怎么测量一个物体中的气泡大小我想测量一个含有气泡物体中气泡的大小,怎么统计,有没有人做过类似的实验? 2020-12-14 …