早教吧作业答案频道 -->化学-->
短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12.回答下列问题:ABCD(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生
题目详情
短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12.回答下列问题:
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1mol气态氢化物所对应的热量变化是___(选填字母编号).
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
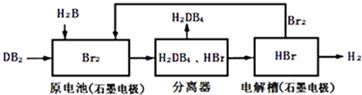
①查得:
试写出通常条件下电解槽中发生总反应的热化学方程式:___
②根据资料:
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到___,证明分离效果较好.
③在原电池中,负极发生的反应式为___.
④在电解过程中,电解槽阴极附近溶液pH___(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:___.该生产工艺的优点有___(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入___,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为___.
A B C D A B A B C D C D 2
2242

化学键 H-H Br-Br H-Br 键能(kJ/mol) 436 194 362 化学键 H-H Br-Br H-Br 化学键 H-H Br-Br H-Br 键能(kJ/mol) 436 194 362 键能(kJ/mol) 436 194 362
化学式 Ag2SO4 AgBr 溶解度(g) 0.796 8.4×10-6 化学式 Ag2SO4 AgBr 化学式 Ag2SO4 24AgBr 溶解度(g) 0.796 8.4×10-6 溶解度(g) 0.796 8.4×10-6 -6243
--3-
| A | B | |
| C | D |
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.

①查得:
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
②根据资料:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
③在原电池中,负极发生的反应式为___.
④在电解过程中,电解槽阴极附近溶液pH___(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:___.该生产工艺的优点有___(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入___,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为___.
| A | B | |
| C | D |
2242

| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
--3-
▼优质解答
答案和解析
由短周期元素A、B、C、D在周期表中的位置,可知A、B处于第二周期,C、D处于第三周期,B、D同主族,二者最外层电子数之和为12,则B为O元素、D为S元素,可推知A为N元素、C为Si.
(1)Se与O元素同族元素,同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号),故生成1mol硒化氢(H22Se)反应热应排在第二位,应为+29.7kJ•mol-1-1,
故答案为:b;
(2)由工艺流程图可知,原电池原理为SO22+Br22+2H22O=H22SO44+2HBr,分离出硫酸,再电 2HBr
H2↑+Br2,获得氢气,电解得到的溴循环利用.
①电解槽中电解HBr,生成H2与Br2,反应方程式为2HBr=H2+Br2,由表中数据可知,△H=362kJ/mol×2-436kJ/mol-194kJ/mol=+94kJ/mol,故热化学方程式为2HBr(aq)=H2(g)+Br2(g)△H=+94kJ/mol,
故答案为:2HBr(aq)=H2(g)+Br2(g)△H=+94kJ/mol;
②分离后的H2SO4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,
故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
③在原电池中,负极发生氧化反应,SO2在负极放电生成H2SO4,电极反应式为SO2+2H2O-2e-=4H++SO42-,故答案为:SO2+2H2O-2e-=4H++SO42-;
④在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低,溶液pH变大,
故答案为:变大;
⑤原电池中电池总反应为SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,故该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2SO4+H2,该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,
故答案为:SO2+2H2O=H2+H2SO4;Br2被循环利用或能源循环供给或获得清洁能源;
(3)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴在碳酸钠溶液的歧化可把反应理解为溴与水发生歧化,产生H+的被碳酸钠吸收,反应的离子方程式为3:Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑),
故答案为:Cl2;3 Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑).
电解 电解 电解 电解 H22↑+Br22,获得氢气,电解得到的溴循环利用.
①电解槽中电解HBr,生成H22与Br22,反应方程式为2HBr=H22+Br22,由表中数据可知,△H=362kJ/mol×2-436kJ/mol-194kJ/mol=+94kJ/mol,故热化学方程式为2HBr(aq)=H22(g)+Br22(g)△H=+94kJ/mol,
故答案为:2HBr(aq)=H22(g)+Br22(g)△H=+94kJ/mol;
②分离后的H22SO44溶液于试管,向其中逐滴加入AgNO33溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,
故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
③在原电池中,负极发生氧化反应,SO22在负极放电生成H22SO44,电极反应式为SO22+2H22O-2e-=4H+++SO442-2-,故答案为:SO22+2H22O-2e-=4H+++SO442-2-;
④在电解过程中,电解槽阴极发生还原反应,电极反应式为2H+++2e-=H22↑,氢离子浓度降低,溶液pH变大,
故答案为:变大;
⑤原电池中电池总反应为SO22+Br22+2H22O=H22SO44+2HBr,电解池中总反应为2HBr=H22+Br22,故该工艺流程用总反应的化学方程式表示为:SO22+2H22O=H22SO44+H22,该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,
故答案为:SO22+2H22O=H22+H22SO44;Br22被循环利用或能源循环供给或获得清洁能源;
(3)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br--氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴在碳酸钠溶液的歧化可把反应理解为溴与水发生歧化,产生H++的被碳酸钠吸收,反应的离子方程式为3:Br22+6 CO332-2-+3H22O=5 Br--+BrO33--+6HCO33--(或3 Br22+3CO332-2-=5 Br--+BrO33--+3CO22↑),
故答案为:Cl22;3 Br22+6 CO332-2-+3H22O=5 Br--+BrO33--+6HCO33--(或3 Br22+3CO332-2-=5 Br--+BrO33--+3CO22↑).
(1)Se与O元素同族元素,同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号),故生成1mol硒化氢(H22Se)反应热应排在第二位,应为+29.7kJ•mol-1-1,
故答案为:b;
(2)由工艺流程图可知,原电池原理为SO22+Br22+2H22O=H22SO44+2HBr,分离出硫酸,再电 2HBr
| ||
①电解槽中电解HBr,生成H2与Br2,反应方程式为2HBr=H2+Br2,由表中数据可知,△H=362kJ/mol×2-436kJ/mol-194kJ/mol=+94kJ/mol,故热化学方程式为2HBr(aq)=H2(g)+Br2(g)△H=+94kJ/mol,
故答案为:2HBr(aq)=H2(g)+Br2(g)△H=+94kJ/mol;
②分离后的H2SO4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,
故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
③在原电池中,负极发生氧化反应,SO2在负极放电生成H2SO4,电极反应式为SO2+2H2O-2e-=4H++SO42-,故答案为:SO2+2H2O-2e-=4H++SO42-;
④在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低,溶液pH变大,
故答案为:变大;
⑤原电池中电池总反应为SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,故该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2SO4+H2,该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,
故答案为:SO2+2H2O=H2+H2SO4;Br2被循环利用或能源循环供给或获得清洁能源;
(3)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴在碳酸钠溶液的歧化可把反应理解为溴与水发生歧化,产生H+的被碳酸钠吸收,反应的离子方程式为3:Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑),
故答案为:Cl2;3 Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑).
| ||
| 电解 |
. |
| 电解 |
. |
| 电解 |
. |
| 电解 |
. |
.
.
.
.
.①电解槽中电解HBr,生成H22与Br22,反应方程式为2HBr=H22+Br22,由表中数据可知,△H=362kJ/mol×2-436kJ/mol-194kJ/mol=+94kJ/mol,故热化学方程式为2HBr(aq)=H22(g)+Br22(g)△H=+94kJ/mol,
故答案为:2HBr(aq)=H22(g)+Br22(g)△H=+94kJ/mol;
②分离后的H22SO44溶液于试管,向其中逐滴加入AgNO33溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,
故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
③在原电池中,负极发生氧化反应,SO22在负极放电生成H22SO44,电极反应式为SO22+2H22O-2e-=4H+++SO442-2-,故答案为:SO22+2H22O-2e-=4H+++SO442-2-;
④在电解过程中,电解槽阴极发生还原反应,电极反应式为2H+++2e-=H22↑,氢离子浓度降低,溶液pH变大,
故答案为:变大;
⑤原电池中电池总反应为SO22+Br22+2H22O=H22SO44+2HBr,电解池中总反应为2HBr=H22+Br22,故该工艺流程用总反应的化学方程式表示为:SO22+2H22O=H22SO44+H22,该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,
故答案为:SO22+2H22O=H22+H22SO44;Br22被循环利用或能源循环供给或获得清洁能源;
(3)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br--氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴在碳酸钠溶液的歧化可把反应理解为溴与水发生歧化,产生H++的被碳酸钠吸收,反应的离子方程式为3:Br22+6 CO332-2-+3H22O=5 Br--+BrO33--+6HCO33--(或3 Br22+3CO332-2-=5 Br--+BrO33--+3CO22↑),
故答案为:Cl22;3 Br22+6 CO332-2-+3H22O=5 Br--+BrO33--+6HCO33--(或3 Br22+3CO332-2-=5 Br--+BrO33--+3CO22↑).
看了 短周期元素A、B、C、D在周...的网友还看了以下:
下列关于元素周期表的说法正确的是A.在元素周期表中,每一列就是一个族B.主族元素都是短周期元素C. 2020-04-08 …
下列关于元素周期表的叙述中正确的是()A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素 2020-04-08 …
下列有关元朝民族关系的叙述,不正确的是()A.元朝建立前蒙古族处于分裂状态,并受到女真贵族的压迫B 2020-06-11 …
下列有关元朝民族关系的叙述,不正确的是A.元朝建立以前,蒙古族处于分裂状态并受到女真族的压迫B.元 2020-06-11 …
下列关于ⅦA族元素的叙述正确的是()A.ⅦA族元素是同周期中原子半径最大的元素(惰性气体元素除外) 2020-07-16 …
13.下列关于元朝民族关系的叙述,不正确的是()A.回族的形成是元朝民族融合的重要体现B.元朝的统 2020-07-28 …
13.下列关于元朝民族关系的叙述,不正确的是()A.回族的形成是元朝民族融合的重要体现B.元朝的统 2020-07-28 …
下列关于元素周期表的叙述,正确的是()A.ⅡA族中无非金属元素B.Ⅷ族中所含元素种类最多C.元素周期 2020-12-02 …
下列关于元素周期表的叙述,正确的是:()A.ⅡA族中无非金属元素B.Ⅷ族中所含元素种类最多C.元素周 2020-12-27 …
填空题.李老师买了5副乒乓球拍,每副a元,还剩下b元,他一共带了()元.方程9x-0.9x=0.81 2021-01-17 …