早教吧作业答案频道 -->化学-->
利用如图1装置测定中和热的实验步骤如下:①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入
题目详情
利用如图1装置测定中和热的实验步骤如下:
①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
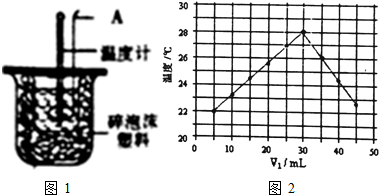
(1)仪器A的名称为___.
(2)写成稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol)___.
(3)倒入NaOH溶液的正确操作是___(填序号).
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是E(从下列选出)___.
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=___(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)将V1mL1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).则NaOH溶液的物质的量浓度为___.

温度
实验次数 起始温度t1℃ 终止温度t2℃ 温度差平均值(t2-t1)℃ H2SO4 NaOH 平均值 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 温度
实验次数 起始温度t1℃ 终止温度t2℃ 温度差平均值(t2-t1)℃ 温度
实验次数
起始温度t1℃ 1终止温度t2℃ 2温度差平均值(t2-t1)℃ 21 H2SO4 NaOH 平均值 H2SO4 24NaOH 平均值 1 26.2 26.0 26.1 29.5 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 32.3 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 4 26.4 26.2 26.3 29.8 3
24
1212
①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:

(1)仪器A的名称为___.
(2)写成稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol)___.
(3)倒入NaOH溶液的正确操作是___(填序号).
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是E(从下列选出)___.
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)将V1mL1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).则NaOH溶液的物质的量浓度为___.

| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
实验次数
实验次数
实验次数
24
1212
▼优质解答
答案和解析
(1)仪器A的名称为环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)强酸强碱的中和热为-57.3kJ/mol,中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,稀硫酸和稀氢氧化钠溶液反应的热化学方程式为:
H2SO4(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
故答案为:
H2SO4(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1 2 1 1 12 2 2H22SO44(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
故答案为:
H2SO4(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1 2 1 1 12 2 2Na22SO44(l)+H22O(l)△H=-57.3KJ/mol;
故答案为:
H2SO4(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1 2 1 1 12 2 2H22SO44(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1 2 1 1 12 2 2Na22SO44(l)+H22O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1.4212kJ 0.025mol 1.4212kJ 1.4212kJ 1.4212kJ0.025mol 0.025mol 0.025mol=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H22SO44测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V11为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V11+V22=50mL,所以V22为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1-1;
故答案为:1.5 mol•L-1-1.
(2)强酸强碱的中和热为-57.3kJ/mol,中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,稀硫酸和稀氢氧化钠溶液反应的热化学方程式为:
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1 |
| 2 |
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H22SO44测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V11为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V11+V22=50mL,所以V22为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1-1;
故答案为:1.5 mol•L-1-1.
看了 利用如图1装置测定中和热的实...的网友还看了以下:
(1)将0.15mol·L-1稀硫酸V1mL与0.1mol·L-1NaOH溶液V2mL混合,所得溶 2020-04-12 …
计算下列物质的质量(1)0.2mol硫酸(2)5mol金属铝计算下列物质的物质的量(1)88克的二 2020-05-13 …
稀释后的稀硫酸溶液H+=5g/l,请问PH值应该是多少?计算公式我也知道,公式中的浓度单位为mol 2020-05-15 …
(1)常温下,0.05mol/L硫酸溶液中,c(H+)=mol/L,pH值为,水电离的c(H+)= 2020-05-15 …
将Cu与CuO的混合物75.2g加入到100ml18.4mol/L的浓硫酸中,加热,固体完全溶解反 2020-05-16 …
烟气脱硫怎么计算石膏产量所用原料是电石渣(成分主要是Coca3),锅炉为循环流化床锅炉,钙硫比是1 2020-07-06 …
定积分计算∫l/(d^2/4+l^2)^(3/2)*dl在[0,l]上的积分能计算吗?d是常数∫L 2020-08-02 …
环境工程脱硫除尘双碱法液气比的换算?采用双碱法(氢氧化钠)工艺,确定液气比L/G=2,10万烟气量, 2020-11-08 …
amol铁和bmol硫磺隔绝空气加热,充分反应,再将反应混合物与足量稀硫酸在适当条件下反应.1)生成 2020-12-24 …
溶液的配制及分析的关公式都有什么,重点什么?例如实验室需要93ml2mol/L的氯化钠溶液所需的氯化 2021-01-22 …