早教吧作业答案频道 -->化学-->
为探究测定中和热的实验,小明利用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mo
题目详情
为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).
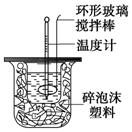
(1)写出实验所进行的中和反应的热化学方程式___.
(2)实验装置中,烧杯间填满碎纸条的作用为___.
(3)该实验中,使用浓度略大于盐酸的NaOH溶液的原因是___,若改用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1,NaOH溶液进行反应,所求中和热的数值___(填“相等”或“不相等”),理由是___.
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是___.
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓 D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大.为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).

(1)写出实验所进行的中和反应的热化学方程式___.
(2)实验装置中,烧杯间填满碎纸条的作用为___.
(3)该实验中,使用浓度略大于盐酸的NaOH溶液的原因是___,若改用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1,NaOH溶液进行反应,所求中和热的数值___(填“相等”或“不相等”),理由是___.
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是___.
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓 D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大.-1-1

-1-1

(1)写出实验所进行的中和反应的热化学方程式___.
(2)实验装置中,烧杯间填满碎纸条的作用为___.
(3)该实验中,使用浓度略大于盐酸的NaOH溶液的原因是___,若改用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1,NaOH溶液进行反应,所求中和热的数值___(填“相等”或“不相等”),理由是___.
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是___.
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓 D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大.为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).

(1)写出实验所进行的中和反应的热化学方程式___.
(2)实验装置中,烧杯间填满碎纸条的作用为___.
(3)该实验中,使用浓度略大于盐酸的NaOH溶液的原因是___,若改用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1,NaOH溶液进行反应,所求中和热的数值___(填“相等”或“不相等”),理由是___.
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是___.
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓 D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大.-1-1

-1-1
▼优质解答
答案和解析
(1)稀的强酸与强碱溶液反应的中和热数值为57.3kJ/mol,则稀盐酸与稀NaOH溶液中和反应的热化学方程式:HCl (aq)+NaOH (aq)=H22O (l)+NaCl (aq)△H=-57.3kJ/mol;
故答案为:HCl (aq)+NaOH (aq)=H22O (l)+NaCl (aq)△H=-57.3kJ/mol;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温隔热、减少热量损失;
故答案为:保温隔热、减少热量损失;
(3)实验中,所用NaOH稍过量的原因是确保定量的HCl反应完全;反应放出的热量和所用酸以及碱的量的多少有关,用60mL 0.50mol•L-1-1盐酸跟50mL 0.55mol•L-1 -1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL 0.50mol•L-1-1盐酸跟50mL 0.55mol•L-1 -1 NaOH溶液,测得中和热数值相等;
故答案为:确保定量的HCl反应完全;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H22O放出的热量,与酸碱的用量无;
(4)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;
B、做本实验的室温和反应热的数据之间无关,故B错误;
C、将量筒中的NaOH(aq)倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故C正确;
D、在量取盐酸时仰视读数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,导致实验测得中和热的数值偏高,故D错误;
E、大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低,故E正确.
故答案为:A C E.
故答案为:HCl (aq)+NaOH (aq)=H22O (l)+NaCl (aq)△H=-57.3kJ/mol;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温隔热、减少热量损失;
故答案为:保温隔热、减少热量损失;
(3)实验中,所用NaOH稍过量的原因是确保定量的HCl反应完全;反应放出的热量和所用酸以及碱的量的多少有关,用60mL 0.50mol•L-1-1盐酸跟50mL 0.55mol•L-1 -1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL 0.50mol•L-1-1盐酸跟50mL 0.55mol•L-1 -1 NaOH溶液,测得中和热数值相等;
故答案为:确保定量的HCl反应完全;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H22O放出的热量,与酸碱的用量无;
(4)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;
B、做本实验的室温和反应热的数据之间无关,故B错误;
C、将量筒中的NaOH(aq)倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故C正确;
D、在量取盐酸时仰视读数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,导致实验测得中和热的数值偏高,故D错误;
E、大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低,故E正确.
故答案为:A C E.
看了 为探究测定中和热的实验,小明...的网友还看了以下:
5多左L多.5多左ol•L-1盐酸和5多左L&rbsp;多.55左ol•L-1烧碱溶液在如下图所示 2020-04-08 …
用如何spss软件进行单因素方差分析和t检验0 μmol/L 0.5 μmol/L 1μmol/L 2020-05-15 …
A=zeros(2,5); A(:)=-4:5 L=abs(A)>3 islogical(L) X 2020-05-16 …
在直线l:3x-y-5=0上找一点P,使P到A(5,1)B(4,4)的距离最小,求出最小值在直线l 2020-06-04 …
椭圆周长是多少?有两个直径:A=19,B=17,这样一个椭圆形,它的周长是多少?谁会?2楼的同学, 2020-06-06 …
油菜素内酯(BL)是植物体内合成的甾醇类激素,科研人员以拟南芥为材料,研究其含量调节机制,做了如下 2020-07-24 …
已知关于整数x的二次三项式ax2+bx+c当x取1,3,6,8时,某同学算得这个二次三项式的值分别 2020-08-03 …
从方框中七个选项中选择五个适当的句子补全对话(5分)。(L=MrsLiA=AgonyAunt)L:H 2020-10-30 …
根据下列某学生血常规化验报告单数据,判断正确的选项是()样品检验项目检测结果参考范围血检白细胞13. 2020-11-20 …
你帮我回答的化简函数很厉害,你还可以帮我化简几道题吗?用卡诺图法化简1题L=∑m(0,1,3,5,7 2020-12-23 …