早教吧作业答案频道 -->化学-->
氰化钠,白色结晶颗粒或粉末,易潮解,剧毒,水溶液显弱碱性,化学式为NaCN,熔点为563.1℃,是一种重要的化工原料,多用于化学合成,电镀冶金等方面.其制备工艺如图:(1)制备过程
题目详情
氰化钠,白色结晶颗粒或粉末,易潮解,剧毒,水溶液显弱碱性,化学式为NaCN,熔点为563.1℃,是一种重要的化工原料,多用于化学合成,电镀冶金等方面.其制备工艺如图:
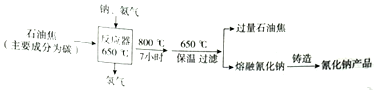
(1)制备过程的化学反应方程式为___.
(2)工厂中,氰化钠存储区应贴的标志图1为___(填选项字母).

(3)已知NaCN中碳、氮原子均满足8电子稳定结构,其电子式为___.
(4)丙烯氨氧化法制丙烯腈的过程中有大量副产物HCN,HCN被NaOH溶液吸收,也是制备NaCN的一种重要方法.含等物质的量的NaCN和HCN的混合溶液,其pH>7,该溶液中下列关系式一定正确的是___(填选项字母).
A.2c(Na+)=c(CN-) B.c(CN-)<c(HCN)
C.c(H+)=c(OH-)-c(HCN) D.c(Na+)-c(CN-)=c(OH-)-C(H+)
已知25℃时,HCN的电离平衡常数Ka=4.9×10-10,则该温度下NaCN的水解平衡常数Kb=___(结果保留到小数点后一位).
(5)泄露的含NaCN的溶液可用双氧水处理,生成一种常见的酸式盐和一种常见的碱性气体,化学方程式为___.
(6)某废水样品中主要含有CN-和Cl-,若用电解法除去废水中的CN-,装置如图2所示,控制废水的pH范围在9~10,阳极产生的ClO-可将CN-氧化为N2和CO32-,阳极的电极反应式为___.除去CN-的离子反应方程式为___.氰化钠,白色结晶颗粒或粉末,易潮解,剧毒,水溶液显弱碱性,化学式为NaCN,熔点为563.1℃,是一种重要的化工原料,多用于化学合成,电镀冶金等方面.其制备工艺如图:

(1)制备过程的化学反应方程式为___.
(2)工厂中,氰化钠存储区应贴的标志图1为___(填选项字母).

(3)已知NaCN中碳、氮原子均满足8电子稳定结构,其电子式为___.
(4)丙烯氨氧化法制丙烯腈的过程中有大量副产物HCN,HCN被NaOH溶液吸收,也是制备NaCN的一种重要方法.含等物质的量的NaCN和HCN的混合溶液,其pH>7,该溶液中下列关系式一定正确的是___(填选项字母).
A.2c(Na+)=c(CN-) B.c(CN-)<c(HCN)
C.c(H+)=c(OH-)-c(HCN) D.c(Na+)-c(CN-)=c(OH-)-C(H+)
已知25℃时,HCN的电离平衡常数Ka=4.9×10-10,则该温度下NaCN的水解平衡常数Kb=___(结果保留到小数点后一位).
(5)泄露的含NaCN的溶液可用双氧水处理,生成一种常见的酸式盐和一种常见的碱性气体,化学方程式为___.
(6)某废水样品中主要含有CN-和Cl-,若用电解法除去废水中的CN-,装置如图2所示,控制废水的pH范围在9~10,阳极产生的ClO-可将CN-氧化为N2和CO32-,阳极的电极反应式为___.除去CN-的离子反应方程式为___.


+--
+-+--+
a-10b
-----232--

(1)制备过程的化学反应方程式为___.
(2)工厂中,氰化钠存储区应贴的标志图1为___(填选项字母).

(3)已知NaCN中碳、氮原子均满足8电子稳定结构,其电子式为___.
(4)丙烯氨氧化法制丙烯腈的过程中有大量副产物HCN,HCN被NaOH溶液吸收,也是制备NaCN的一种重要方法.含等物质的量的NaCN和HCN的混合溶液,其pH>7,该溶液中下列关系式一定正确的是___(填选项字母).
A.2c(Na+)=c(CN-) B.c(CN-)<c(HCN)
C.c(H+)=c(OH-)-c(HCN) D.c(Na+)-c(CN-)=c(OH-)-C(H+)
已知25℃时,HCN的电离平衡常数Ka=4.9×10-10,则该温度下NaCN的水解平衡常数Kb=___(结果保留到小数点后一位).
(5)泄露的含NaCN的溶液可用双氧水处理,生成一种常见的酸式盐和一种常见的碱性气体,化学方程式为___.
(6)某废水样品中主要含有CN-和Cl-,若用电解法除去废水中的CN-,装置如图2所示,控制废水的pH范围在9~10,阳极产生的ClO-可将CN-氧化为N2和CO32-,阳极的电极反应式为___.除去CN-的离子反应方程式为___.氰化钠,白色结晶颗粒或粉末,易潮解,剧毒,水溶液显弱碱性,化学式为NaCN,熔点为563.1℃,是一种重要的化工原料,多用于化学合成,电镀冶金等方面.其制备工艺如图:

(1)制备过程的化学反应方程式为___.
(2)工厂中,氰化钠存储区应贴的标志图1为___(填选项字母).

(3)已知NaCN中碳、氮原子均满足8电子稳定结构,其电子式为___.
(4)丙烯氨氧化法制丙烯腈的过程中有大量副产物HCN,HCN被NaOH溶液吸收,也是制备NaCN的一种重要方法.含等物质的量的NaCN和HCN的混合溶液,其pH>7,该溶液中下列关系式一定正确的是___(填选项字母).
A.2c(Na+)=c(CN-) B.c(CN-)<c(HCN)
C.c(H+)=c(OH-)-c(HCN) D.c(Na+)-c(CN-)=c(OH-)-C(H+)
已知25℃时,HCN的电离平衡常数Ka=4.9×10-10,则该温度下NaCN的水解平衡常数Kb=___(结果保留到小数点后一位).
(5)泄露的含NaCN的溶液可用双氧水处理,生成一种常见的酸式盐和一种常见的碱性气体,化学方程式为___.
(6)某废水样品中主要含有CN-和Cl-,若用电解法除去废水中的CN-,装置如图2所示,控制废水的pH范围在9~10,阳极产生的ClO-可将CN-氧化为N2和CO32-,阳极的电极反应式为___.除去CN-的离子反应方程式为___.


+--
+-+--+
a-10b
-----232--
▼优质解答
答案和解析
(1)由流程图可知钠、C、氨气合成生成NaCN,同时生成氢气,反应为:2Na+2C+2NH33
2NaCN+3H2;
故答案为:2Na+2C+2NH3
2NaCN+3H2;
(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键,电子式为: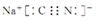 ;
;
故答案为: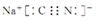 ;
;
(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),错误;
B.pH>7,溶液C(OH-)>C(H+),呈碱性,说明CN-的水解程度大于氢氰酸的电离程度,c(CN-)<c(HCN),正确;
C.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),联合得:2c(H+)=2c(OH-)+c(CN-)-c(HCN),错误;
D.根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),则c(Na+)-c(CN-)=c(OH-)-C(H+),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN-+H2O⇌HCN+OH-;Kh=
=
≈2.0×l0-5;
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
650℃ 650℃ 650℃ 650℃ 2NaCN+3H22;
故答案为:2Na+2C+2NH33
2NaCN+3H2;
(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键,电子式为: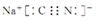 ;
;
故答案为: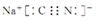 ;
;
(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),错误;
B.pH>7,溶液C(OH-)>C(H+),呈碱性,说明CN-的水解程度大于氢氰酸的电离程度,c(CN-)<c(HCN),正确;
C.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),联合得:2c(H+)=2c(OH-)+c(CN-)-c(HCN),错误;
D.根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),则c(Na+)-c(CN-)=c(OH-)-C(H+),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN-+H2O⇌HCN+OH-;Kh=
=
≈2.0×l0-5;
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
650℃ 650℃ 650℃ 650℃ 2NaCN+3H22;
(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN--中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN--形成离子键,电子式为: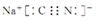 ;
;
故答案为: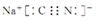 ;
;
(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na++)=c(CN--)+c(HCN),错误;
B.pH>7,溶液C(OH--)>C(H++),呈碱性,说明CN--的水解程度大于氢氰酸的电离程度,c(CN--)C.根据物料守恒:2c(Na++)=c(CN--)+c(HCN),根据电荷守恒知,C(OH--)+c(CN--)=C(H++)+C(Na++),联合得:2c(H++)=2c(OH--)+c(CN--)-c(HCN),错误;
D.根据电荷守恒知,C(OH--)+c(CN--)=C(H++)+C(Na++),则c(Na++)-c(CN--)=c(OH--)-C(H++),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN--+H22O⇌HCN+OH--;Kh=
=
≈2.0×l0-5;
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
Kw Ka Kw Kw KwKa Ka Ka=
≈2.0×l0-5;
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
10-14 4.9×10-10 10-14 10-14 10-14-144.9×10-10 4.9×10-10 4.9×10-10-10≈2.0×l0-5-5;
故答案为:BD;2.0×10-5-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH33、NaHCO33,其反应的方程式为:NaCN+H22O22+H22O=NaHCO33+NH33↑;
故答案为:NaCN+H22O22+H22O=MaHCO33+NH33↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl--+2OH---2e--=ClO--+H22O;ClO--可将CN--氧化为N22和CO332-2-,反应为:2CN--+5ClO--+2OH--=N22↑+2CO332-2-+5Cl--+H22O;
故答案为:Cl--+2OH---2e--=ClO--+H22O;2CN--+5ClO--+2OH--=N22↑+2CO332-2-+5Cl--+H22O.
| ||
故答案为:2Na+2C+2NH3
| ||
(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键,电子式为:
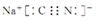 ;
;故答案为:
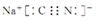 ;
;(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),错误;
B.pH>7,溶液C(OH-)>C(H+),呈碱性,说明CN-的水解程度大于氢氰酸的电离程度,c(CN-)<c(HCN),正确;
C.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),联合得:2c(H+)=2c(OH-)+c(CN-)-c(HCN),错误;
D.根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),则c(Na+)-c(CN-)=c(OH-)-C(H+),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN-+H2O⇌HCN+OH-;Kh=
| Kw |
| Ka |
| 10-14 |
| 4.9×10-10 |
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
| ||
| 650℃ |
. |
| 650℃ |
. |
| 650℃ |
. |
| 650℃ |
. |
.
.
.
.
.故答案为:2Na+2C+2NH33
| ||
(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键,电子式为:
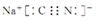 ;
;故答案为:
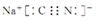 ;
;(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),错误;
B.pH>7,溶液C(OH-)>C(H+),呈碱性,说明CN-的水解程度大于氢氰酸的电离程度,c(CN-)<c(HCN),正确;
C.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),联合得:2c(H+)=2c(OH-)+c(CN-)-c(HCN),错误;
D.根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),则c(Na+)-c(CN-)=c(OH-)-C(H+),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN-+H2O⇌HCN+OH-;Kh=
| Kw |
| Ka |
| 10-14 |
| 4.9×10-10 |
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
| ||
| 650℃ |
. |
| 650℃ |
. |
| 650℃ |
. |
| 650℃ |
. |
.
.
.
.
.(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN--中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN--形成离子键,电子式为:
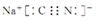 ;
;故答案为:
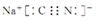 ;
;(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na++)=c(CN--)+c(HCN),错误;
B.pH>7,溶液C(OH--)>C(H++),呈碱性,说明CN--的水解程度大于氢氰酸的电离程度,c(CN--)
D.根据电荷守恒知,C(OH--)+c(CN--)=C(H++)+C(Na++),则c(Na++)-c(CN--)=c(OH--)-C(H++),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN--+H22O⇌HCN+OH--;Kh=
| Kw |
| Ka |
| 10-14 |
| 4.9×10-10 |
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
| Kw |
| Ka |
| 10-14 |
| 4.9×10-10 |
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
| 10-14 |
| 4.9×10-10 |
故答案为:BD;2.0×10-5-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH33、NaHCO33,其反应的方程式为:NaCN+H22O22+H22O=NaHCO33+NH33↑;
故答案为:NaCN+H22O22+H22O=MaHCO33+NH33↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl--+2OH---2e--=ClO--+H22O;ClO--可将CN--氧化为N22和CO332-2-,反应为:2CN--+5ClO--+2OH--=N22↑+2CO332-2-+5Cl--+H22O;
故答案为:Cl--+2OH---2e--=ClO--+H22O;2CN--+5ClO--+2OH--=N22↑+2CO332-2-+5Cl--+H22O.
看了 氰化钠,白色结晶颗粒或粉末,...的网友还看了以下:
2014年3月22日食第二十二届“世界水日”,联合国确定本次活动的主题为“水与能源”,水是一切生物 2020-05-13 …
宁波是一座美丽的海滨城市,海水是一种重要要的自然资源.以下是对海水资源的部分利用.(1)目前从海水 2020-05-16 …
水是一种极弱的电解质,在室温下水的电离常数为1.8×10^(-16),若平均每n个水分子只有一个水 2020-06-25 …
海洋是地球上最广阔的水体的总称,其含水量约占地球上总水量的97%.(1)海水中含有许多化学物质,不 2020-07-16 …
水是一种重要的资源.(1)电解水实验揭示了水的组成.所用的水是(填纯净物或者混合物)图1实验中得到 2020-07-18 …
一种药用盐水是用1份盐和50份水配制成的.(1)有盐50克,要加入多少克水才能配成这种盐水?(2) 2020-07-19 …
水是一种重要的资源.(1)水的组成:电解水实验揭示了水的组成.写出电解水的文字表达式:.小明同学为 2020-07-20 …
海水是一种重要资源,从海水中可提取食盐、MgCl2等多种物质.(1)从海水中提取粗盐一般采用的方法 2020-07-21 …
(1)水是一种重要的资源.我们必须爱护水资源,一方面要节约用水,另一方面要.请提出一条节约用水的生活 2020-11-02 …
水是一切生物生存所必需的,我们应该了解有关水的一些知识。(1)保护水环境、珍爱水资源,是每个公民应尽 2020-11-02 …