早教吧作业答案频道 -->化学-->
过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.已知:N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ
题目详情
过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
H2O2(l)═H2O(l)+
O2(g),△H=-98kJ•mol-1
H2O(l)═H2O(g),△H=+44kJ•mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___.
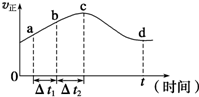
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)⇌NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示.由图可得出的正确说法是___.
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.△t1=△t2时,NO的转化量:a~b段小于b~c段.过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.

(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
H2O2(l)═H2O(l)+
O2(g),△H=-98kJ•mol-1
H2O(l)═H2O(g),△H=+44kJ•mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___.
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)⇌NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示.由图可得出的正确说法是___.
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.△t1=△t2时,NO的转化量:a~b段小于b~c段.

24
24222-1
222
O2(g),△H=-98kJ•mol-1
H2O(l)═H2O(g),△H=+44kJ•mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___.
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)⇌NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示.由图可得出的正确说法是___.
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.△t1=△t2时,NO的转化量:a~b段小于b~c段.
1 2 1 1 2 2 2-1
22-1
2422
3x2x3223
12

(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
H2O2(l)═H2O(l)+
| 1 |
| 2 |
H2O(l)═H2O(g),△H=+44kJ•mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___.
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)⇌NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示.由图可得出的正确说法是___.
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.△t1=△t2时,NO的转化量:a~b段小于b~c段.过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.

(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
H2O2(l)═H2O(l)+
| 1 |
| 2 |
H2O(l)═H2O(g),△H=+44kJ•mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___.
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)⇌NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示.由图可得出的正确说法是___.
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.△t1=△t2时,NO的转化量:a~b段小于b~c段.

24
24222-1
222
| 1 |
| 2 |
H2O(l)═H2O(g),△H=+44kJ•mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___.
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)⇌NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示.由图可得出的正确说法是___.
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.△t1=△t2时,NO的转化量:a~b段小于b~c段.
| 1 |
| 2 |
22-1
2422
3x2x3223
12
▼优质解答
答案和解析
(1)①N22H44(l)+O22(g)═N22(g)+2H22O(g),△H=-534kJ•mol-1-1①
H22O22(l)═H22O(l)+
O2(g),△H=-98kJ•mol-1②
H2O(l)═H2O(g),△H=+44kJ•mol-1③
将①+2②+4③可得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=(-534kJ•mol-1)+2×(-98kJ•mol-1)+4×(+44kJ•mol-1)=-642 kJ•mol-1
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642 kJ•mol-1;
(2)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明正反应为放热反应,c点以后反应正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡.
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,C点未达到平衡状态,故a错误;
b.反应为达平衡,b点在c点之前,浓度反应物浓度:b点大于c点,故b错误;
c.由图可知,c点以前正反应速率增大,说明正反应为放热反应,故c正确;
d.a~b段反应速率小于b~c段反应速率,△t1=△t2时,b~c段反应的NO更多,故NO的转化率:a~b段小于b~c段,故d正确.
故选:cd.
1 2 1 1 12 2 2O22(g),△H=-98kJ•mol-1-1②
H22O(l)═H22O(g),△H=+44kJ•mol-1-1③
将①+2②+4③可得:N22H44(l)+2H22O22(l)=N22(g)+4H22O(g)△H=(-534kJ•mol-1-1)+2×(-98kJ•mol-1-1)+4×(+44kJ•mol-1-1)=-642 kJ•mol-1-1
故答案为:N22H44(l)+2H22O22(l)═N22(g)+4H22O(g)△H=-642 kJ•mol-1-1;
(2)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明正反应为放热反应,c点以后反应正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡.
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,C点未达到平衡状态,故a错误;
b.反应为达平衡,b点在c点之前,浓度反应物浓度:b点大于c点,故b错误;
c.由图可知,c点以前正反应速率增大,说明正反应为放热反应,故c正确;
d.a~b段反应速率小于b~c段反应速率,△t11=△t22时,b~c段反应的NO更多,故NO的转化率:a~b段小于b~c段,故d正确.
故选:cd.
H22O22(l)═H22O(l)+
| 1 |
| 2 |
H2O(l)═H2O(g),△H=+44kJ•mol-1③
将①+2②+4③可得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=(-534kJ•mol-1)+2×(-98kJ•mol-1)+4×(+44kJ•mol-1)=-642 kJ•mol-1
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642 kJ•mol-1;
(2)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明正反应为放热反应,c点以后反应正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡.
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,C点未达到平衡状态,故a错误;
b.反应为达平衡,b点在c点之前,浓度反应物浓度:b点大于c点,故b错误;
c.由图可知,c点以前正反应速率增大,说明正反应为放热反应,故c正确;
d.a~b段反应速率小于b~c段反应速率,△t1=△t2时,b~c段反应的NO更多,故NO的转化率:a~b段小于b~c段,故d正确.
故选:cd.
| 1 |
| 2 |
H22O(l)═H22O(g),△H=+44kJ•mol-1-1③
将①+2②+4③可得:N22H44(l)+2H22O22(l)=N22(g)+4H22O(g)△H=(-534kJ•mol-1-1)+2×(-98kJ•mol-1-1)+4×(+44kJ•mol-1-1)=-642 kJ•mol-1-1
故答案为:N22H44(l)+2H22O22(l)═N22(g)+4H22O(g)△H=-642 kJ•mol-1-1;
(2)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明正反应为放热反应,c点以后反应正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡.
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,C点未达到平衡状态,故a错误;
b.反应为达平衡,b点在c点之前,浓度反应物浓度:b点大于c点,故b错误;
c.由图可知,c点以前正反应速率增大,说明正反应为放热反应,故c正确;
d.a~b段反应速率小于b~c段反应速率,△t11=△t22时,b~c段反应的NO更多,故NO的转化率:a~b段小于b~c段,故d正确.
故选:cd.
看了 过氧化氢和臭氧都是常见的绿色...的网友还看了以下:
若F(X)与F(x+2\1)都是奇函数,则F(1)+F(2)+F(3)+F(4)+F(5)= 2020-05-19 …
我们称一个自然数n是“好数”,如果能找到两个非零自然数k,l(k,l可以相等),使得n=kl+l- 2020-06-12 …
葡萄糖进入红细胞和小肠绒毛上皮细胞得方式1.都是主动运输2.协助扩散主动运输3.都是自由扩散4.主 2020-06-25 …
1.求经过原点且与直线x=1及圆(x-1)^2+(y-2)^2=1都相切的圆的方程. 2020-07-22 …
一动圆与圆A(x+5)^2+y^2=49和圆B(x-5)^2+y^2=1都外切,求动圆圆心P和其轨 2020-07-30 …
已知一个动圆与圆A:(x+2)^2+y^2=49和圆B:(x-5)^2+y^2=1都外切,求这个动 2020-07-31 …
求经过原点且与直线x=1及圆:(x-1)2+(y-2)2=1都相切的圆的标准方程. 2020-08-01 …
如果有穷数列满足条件:即,我们称其为“对称数列”.例如:数列1,2,3,3,2,1和数列1,2,3 2020-08-02 …
在“我”所在学院的教职工内,总共是16名教授和助教(包括“我”在内).但是“我”的职称和性别计算在内 2020-10-30 …
我们都知道“三角形的内角和等于180°”。如图1,教材中是用“延长BC,过点C作CE∥AB”的方法把 2021-02-01 …