在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。老师用下图所
在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于 570 ℃ 时,生成 FeO ,高于 570 ℃ 时,生成 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
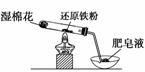
(1) 实验中使用肥皂液的作用是 _________________________________________ 。
(2) 某同学设计下列实验方案以确定实验后试管内的固体是否存在 Fe 3 O 4 。
![]()
确定是否存在 Fe 3 O 4 需要测定并记录的实验数据是 ______________________________
________________________ 。
在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于 570 ℃ 时,生成 FeO ,高于 570 ℃ 时,生成 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

(1) 实验中使用肥皂液的作用是 _________________________________________ 。
(2) 某同学设计下列实验方案以确定实验后试管内的固体是否存在 Fe 3 O 4 。
![]()
确定是否存在 Fe 3 O 4 需要测定并记录的实验数据是 ______________________________
________________________ 。
在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于 570 ℃ 时,生成 FeO ,高于 570 ℃ 时,生成 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
570 ℃ 时,生成 FeO ,高于 570 ℃ 时,生成 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。 ℃ 时,生成 FeO ,高于 570 ℃ 时,生成 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。 FeO ,高于 570 ℃ 时,生成 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。 570 ℃ 时,生成 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。 ℃ 时,生成 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。 Fe 3 O 4 。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。 3 4 


(1) 实验中使用肥皂液的作用是 _________________________________________ 。
(1) 实验中使用肥皂液的作用是 _________________________________________ 。 _________________________________________ 。(2) 某同学设计下列实验方案以确定实验后试管内的固体是否存在 Fe 3 O 4 。
(2) 某同学设计下列实验方案以确定实验后试管内的固体是否存在 Fe 3 O 4 。 Fe 3 O 4 。 3 4 ![]()
确定是否存在 Fe 3 O 4 需要测定并记录的实验数据是 ______________________________
Fe 3 O 4 需要测定并记录的实验数据是 ______________________________ 3 4 ______________________________________________________ 。
________________________ 。
答案 (1) 检验反应中生成的 H 2
(2) 固体样品质量和红棕色固体的质量
解析 本题主要考查实验设计与探究,意在考查学生分析处理实验数据并得出合理结论的能力。为了确定实验后试管内的固体是否存在 Fe 3 O 4 ,必须测定实验后固体中铁与氧的物质的量之比,因黑色粉末溶解时有少量气泡产生,故一定含有金属铁,只有当黑色粉末中 ![]() ≤ 1 时,才一定含有 Fe 3 O 4 ,因此乙同学实验中必须测定固体样品质量和红棕色固体 (Fe 2 O 3 ) 的质量,以确定铁与氧的物质的量之比。
≤ 1 时,才一定含有 Fe 3 O 4 ,因此乙同学实验中必须测定固体样品质量和红棕色固体 (Fe 2 O 3 ) 的质量,以确定铁与氧的物质的量之比。
答案 (1) 检验反应中生成的 H 2
答案 (1) 检验反应中生成的 H 2 2(2) 固体样品质量和红棕色固体的质量
(2) 固体样品质量和红棕色固体的质量 解析 本题主要考查实验设计与探究,意在考查学生分析处理实验数据并得出合理结论的能力。为了确定实验后试管内的固体是否存在 Fe 3 O 4 ,必须测定实验后固体中铁与氧的物质的量之比,因黑色粉末溶解时有少量气泡产生,故一定含有金属铁,只有当黑色粉末中 ![]() ≤ 1 时,才一定含有 Fe 3 O 4 ,因此乙同学实验中必须测定固体样品质量和红棕色固体 (Fe 2 O 3 ) 的质量,以确定铁与氧的物质的量之比。
≤ 1 时,才一定含有 Fe 3 O 4 ,因此乙同学实验中必须测定固体样品质量和红棕色固体 (Fe 2 O 3 ) 的质量,以确定铁与氧的物质的量之比。
又是数学题一道!某厂对该厂生产的两种产品A和B在市场上的占有率进行调查,在被调查的家庭中有三分之一 2020-06-06 …
某企业福利部门领用产品一批自用,该产品的账面价值20000元,市场价为40000元(不含增值税), 2020-06-20 …
6.把遗产视为一个整体,不区分动产和不动产,在涉外继承关系中统一适用单一的被继承人属人法的原则是( 2020-06-27 …
为什么动物生娃不用产婆,人类生娃需要产婆? 2020-06-27 …
为什么磁通量变化会产生感应电流?涡流的产生并不用发生位移只是磁场变化就能产生为什么?我看为什么磁通 2020-07-15 …
20.《民法通则》第144条规定,“不动产的所有权,适用不动产所在地法律”。其中,不动产可以是()。 2020-11-07 …
叶绿体产生的ATP为什么不用于直接供能,而用于合成糖类,再经过呼吸作用产生的ATP才用于直接供能.这 2020-11-16 …
“绿色化学”的核心理念是指()A.颜色为绿色的无害化工产品B.能研究和创造自然界不存在的物质C.少用 2020-11-21 …
如何祛痘方法不用产品 2021-04-23 …
如何祛痘方法不用产品 2021-04-23 …