早教吧作业答案频道 -->化学-->
氯酸钠(NaClO3)是无机盐工业的重要产品之一.(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的(填试剂化学式),过滤后即可得到.(2)
题目详情
氯酸钠(NaClO3)是无机盐工业的重要产品之一.
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的___(填试剂化学式),过滤后即可得到.
(2)实验室制取氯酸钠可通过如下反应:
3C12+6NaOH
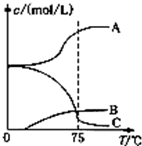
5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子
是___.
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则反应化学方程式为:___.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L
(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL.
步骤4:___.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为___;静置10min的目的是___.
②步骤3中K2Cr2O7标准溶液应盛放在___(填仪器名称)中.
③为精确测定样品中C1O3-的质量分数,步骤4操作为___.
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是___.3

2
5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子
是___.
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则反应化学方程式为:___.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L
(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL.
步骤4:___.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为___;静置10min的目的是___.
②步骤3中K2Cr2O7标准溶液应盛放在___(填仪器名称)中.
③为精确测定样品中C1O3-的质量分数,步骤4操作为___.
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是___.
△ △ △ 322
3-
4242
227
227
3-

(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的___(填试剂化学式),过滤后即可得到.
(2)实验室制取氯酸钠可通过如下反应:
3C12+6NaOH
| ||
是___.
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则反应化学方程式为:___.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L
(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL.
步骤4:___.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为___;静置10min的目的是___.
②步骤3中K2Cr2O7标准溶液应盛放在___(填仪器名称)中.
③为精确测定样品中C1O3-的质量分数,步骤4操作为___.
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是___.3

2
| ||
是___.
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则反应化学方程式为:___.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L
(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL.
步骤4:___.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为___;静置10min的目的是___.
②步骤3中K2Cr2O7标准溶液应盛放在___(填仪器名称)中.
③为精确测定样品中C1O3-的质量分数,步骤4操作为___.
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是___.
| ||
| △ |
| . |
| △ |
| . |
| △ |
| . |
| △ |
| . |
.
.
.
.
3-
4242
227
227
3-
▼优质解答
答案和解析
热的石灰乳通入氯气,反应的方程式为:2Cl22+2Ca(OH)22
CaCl2+Ca(ClO)2+2H2O,除去CaCl2后主要成分为Ca(ClO)2,要加入钠盐得到NaClO3,应加入Na2CO3,发生复分解反应生成碳酸钙沉淀,
故答案为:Na2CO3;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3,图中C的浓度随着温度的升高而减小,所以C代表ClO-;
故答案为:ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成氢气,其反应的方程式为:NaC1+3H2O
NaC1O3+3H2↑;
故答案为:NaC1+3H2O
NaC1O3+3H2↑;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;静置10min可以使亚铁离子和ClO3-充分反应;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O3-的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
加热 加热 加热 加热 CaCl22+Ca(ClO)22+2H22O,除去CaCl22后主要成分为Ca(ClO)22,要加入钠盐得到NaClO33,应加入Na22CO33,发生复分解反应生成碳酸钙沉淀,
故答案为:Na22CO33;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O33,图中C的浓度随着温度的升高而减小,所以C代表ClO--;
故答案为:ClO--;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成氢气,其反应的方程式为:NaC1+3H22O
NaC1O3+3H2↑;
故答案为:NaC1+3H2O
NaC1O3+3H2↑;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;静置10min可以使亚铁离子和ClO3-充分反应;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O3-的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
通电 通电 通电 通电 NaC1O33+3H22↑;
故答案为:NaC1+3H22O
NaC1O3+3H2↑;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;静置10min可以使亚铁离子和ClO3-充分反应;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O3-的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
通电 通电 通电 通电 NaC1O33+3H22↑;
(4)①酸性条件下,亚铁离子被ClO33--氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO33--+6Fe2+2++6H++=Cl--+6Fe3+3++3H22O;静置10min可以使亚铁离子和ClO33--充分反应;
故答案为:ClO33--+6Fe2+2++6H++=Cl--+6Fe3+3++3H22O;使溶液中C1O33--与Fe2+2+反应充分完全;
②K22Cr22O77溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O33--的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+2+被空气中的氧气,则溶液中Fe2+2+的浓度会减小,在滴定时消耗的(NH44)22Fe(SO44)22溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+2+被空气中的氧气氧化.
| ||
故答案为:Na2CO3;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3,图中C的浓度随着温度的升高而减小,所以C代表ClO-;
故答案为:ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成氢气,其反应的方程式为:NaC1+3H2O
| ||
故答案为:NaC1+3H2O
| ||
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;静置10min可以使亚铁离子和ClO3-充分反应;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O3-的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
| ||
| 加热 |
. |
| 加热 |
. |
| 加热 |
. |
| 加热 |
. |
.
.
.
.
.故答案为:Na22CO33;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O33,图中C的浓度随着温度的升高而减小,所以C代表ClO--;
故答案为:ClO--;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成氢气,其反应的方程式为:NaC1+3H22O
| ||
故答案为:NaC1+3H2O
| ||
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;静置10min可以使亚铁离子和ClO3-充分反应;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O3-的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
| ||
| 通电 |
. |
| 通电 |
. |
| 通电 |
. |
| 通电 |
. |
.
.
.
.
.故答案为:NaC1+3H22O
| ||
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;静置10min可以使亚铁离子和ClO3-充分反应;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O3-的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
| ||
| 通电 |
. |
| 通电 |
. |
| 通电 |
. |
| 通电 |
. |
.
.
.
.
.(4)①酸性条件下,亚铁离子被ClO33--氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO33--+6Fe2+2++6H++=Cl--+6Fe3+3++3H22O;静置10min可以使亚铁离子和ClO33--充分反应;
故答案为:ClO33--+6Fe2+2++6H++=Cl--+6Fe3+3++3H22O;使溶液中C1O33--与Fe2+2+反应充分完全;
②K22Cr22O77溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O33--的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+2+被空气中的氧气,则溶液中Fe2+2+的浓度会减小,在滴定时消耗的(NH44)22Fe(SO44)22溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+2+被空气中的氧气氧化.
看了 氯酸钠(NaClO3)是无机...的网友还看了以下:
二次相遇问题甲乙两人同时从A、B两地同时出发相向而行,甲到达B地后立即往回走,回到A地后又立即向B 2020-06-04 …
甲、乙两人同时从A、B两地出发相向而行,甲到达B地后立即往回走,回到A地后,又立即向B地走去乙到达 2020-06-12 …
甲、乙两人同时从A、B两地出发,相向而行,甲到达B地后,立即往回走,回到A地后,又立即向B地走去; 2020-06-12 …
甲乙两人同时从AB两地出发,相向前行,甲到达B地后,立即往回走,回到A地后,又立即向B地走去;乙到 2020-06-12 …
甲、乙两人同时从A、B两地出发,相向而行,甲到达B地后,立即往回走,回到A地后,又立即向B地走去; 2020-06-12 …
墨墨的家距离学校2.1千米,早上到学校后发现数学作业落在家中了,此时距上课时间还有42分钟,于是他 2020-06-28 …
其时我是十八岁,便旅行到南京,考入水师学堂了,分在机关科。大约过了半年,我又走出,改进矿路学堂去学开 2020-12-26 …
墨墨的家距离学校2.1千米,早上到学校后发现数学作业落在家中了,此时距上课时间还有42分钟,于是他立 2021-01-07 …
甲、乙两人同时从A、B两地出发,相向而行,甲到达B地后,立即往回走,回到A地后,又立即向B地走去;乙 2021-01-14 …
甲乙两人同时从AB两地出发相向而行,甲到达B地后立即往回走回到A地后又立即向B地走去,乙到达A地后立 2021-01-14 …