早教吧作业答案频道 -->化学-->
从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化.(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是(填字母序号).a.Feb.FeOc.Fe3O4
题目详情
从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化.
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是___(填字母
序号).
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)现代利用铁的氧化物循环裂解水制氢气的过程如图1所示.整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行.
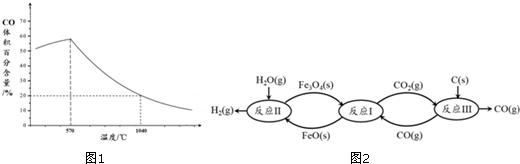
①已知:Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
3FeO(s)+H2O(g)⇌Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
C(s)+CO2(g)⇌2CO(g)△H3═+172.4kJ•mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是___.
②如图2表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系.
i.反应Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)△H___0(填“>”、“<”或“=”),理
由是___.
ii.随温度升高,反应Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)平衡常数的变化趋势是___;1040℃时,该反应的化学平衡常数的数值是___.
(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是___.
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
食品待测液
HCN(气体)
试纸变蓝
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用___.
3423
342

3421-1
23422-1
23-1
34
342
342

-
HCN(气体)
试纸变蓝
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用___.
10%H2SO4 加热煮沸 10%H2SO4 10%H2SO4 H2SO4H2SO42SO4O4O44 加热煮沸 加热煮沸
试纸变蓝
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用___.
FeSO4碱性试纸 FeSO4碱性试纸 FeSO4碱性试纸 O4碱性试纸O4碱性试纸4碱性试纸
-4
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是___(填字母
序号).
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)现代利用铁的氧化物循环裂解水制氢气的过程如图1所示.整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行.

①已知:Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
3FeO(s)+H2O(g)⇌Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
C(s)+CO2(g)⇌2CO(g)△H3═+172.4kJ•mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是___.
②如图2表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系.
i.反应Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)△H___0(填“>”、“<”或“=”),理
由是___.
ii.随温度升高,反应Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)平衡常数的变化趋势是___;1040℃时,该反应的化学平衡常数的数值是___.
(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是___.
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
食品待测液
| 10%H2SO4 |
| |
| 加热煮沸 |
| FeSO4碱性试纸 |
| |
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用___.
3423
342

3421-1
23422-1
23-1
34
342
342

-
| 10%H2SO4 |
| |
| 加热煮沸 |
| FeSO4碱性试纸 |
| |
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用___.
| 10%H2SO4 |
| |
| 加热煮沸 |
| FeSO4碱性试纸 |
| |
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用___.
| FeSO4碱性试纸 |
| |
-4
▼优质解答
答案和解析
(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,选c,故答案为:c;(2)①Ⅰ.Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1Ⅱ.3FeO(s)+H2O(g)⇌Fe3O4(s)+H2...
看了 从古至今,铁及其化合物在人类...的网友还看了以下:
我有一个关于电磁感应的问题;一个导体棒在竖直磁场中切割磁感线运动也产生电流,(它的磁通量没有发生变 2020-05-12 …
在电磁感应现象中,下列说法正确的是1、感应电流的磁场总是跟原来的磁场方向相反2、闭合线框放在变化的 2020-06-04 …
导线在磁场中运动产生感应电动势,一定要运动方向与磁场线不平行吗书上是这样写的,说在固定磁场中,线圈 2020-07-13 …
通电导体棒切割磁场是否产生感应电动势,是否会对外部电源产生影响?就是说导体棒本身已经处在一个有电源 2020-07-22 …
电磁感应问题闭合导线的一部分,在匀强磁场中,切割磁感线运动,电线就会产生电流.导线切割磁感线时,通 2020-07-26 …
两个导体棒在磁场中构成闭合回路,一个在外力作用下运动,切割磁感线产生感应电流,则另一个由于有电流通 2020-07-26 …
在电磁感应现象中,下列说法中正确的是()A.感应电流的磁场总是跟原来的磁场方向相反B.闭合线框放在 2020-07-26 …
如图所示的奥斯特实验说明了()A.导线做切割磁感线运动时会产生电流B.电流在磁场中会受到力的作用C 2020-07-26 …
1、根据高中物理法拉第的电磁学定理,产生感应电动势需要磁通量发生变化,但是如果闭合电路在匀强磁场中 2020-07-26 …
电磁场理论预言了什么()A.预言了变化的磁场能够在周围空间产生电场B.预言了变化的电场能够在周围产生 2021-01-16 …