早教吧作业答案频道 -->化学-->
用霞石岩(化学式为KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12.溶解过滤流程产生的滤液
题目详情
用霞石岩(化学式为KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
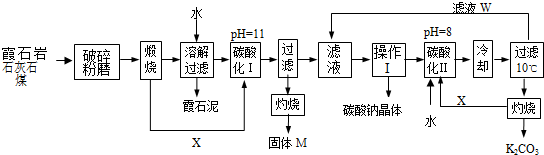
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12.溶解过滤流程产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中.部分物质的溶解度见图.试回答下列问题: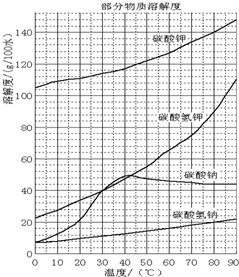
(1)霞石岩添加石灰石和煤,煤的作用是___
(2)灼烧得到固体M的化学方程式是:___.
(3)X物质是___(填化学式,下同),霞石泥的主要成分是___,滤液W中主要含有的离子有___(填三种).
(4)操作Ⅰ得到碳酸钠晶体的操作为___、___、___、洗涤、干燥.
(5)碳酸化Ⅰ中发生主要反应的离子方程式是___.
(6)碳酸化Ⅱ调整pH=8的目的是___.34422232

323

已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12.溶解过滤流程产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中.部分物质的溶解度见图.试回答下列问题:

(1)霞石岩添加石灰石和煤,煤的作用是___
(2)灼烧得到固体M的化学方程式是:___.
(3)X物质是___(填化学式,下同),霞石泥的主要成分是___,滤液W中主要含有的离子有___(填三种).
(4)操作Ⅰ得到碳酸钠晶体的操作为___、___、___、洗涤、干燥.
(5)碳酸化Ⅰ中发生主要反应的离子方程式是___.
(6)碳酸化Ⅱ调整pH=8的目的是___.34422232

323

▼优质解答
答案和解析
霞石岩加石灰石和煤粉碎煅烧碳酸钙分解产生二氧化碳即X,再用水溶解,过滤除去在滤渣霞石泥中的钙和硅等其他杂质,所得溶液碳酸化调PH值到11使溶液中的铝离子沉淀,所以过滤出的沉淀是氢氧化铝,灼烧得到的固体M为氧化铝,滤液经过蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即得碳酸钠晶体,再将溶液碳酸化到PH值为8,所得溶液为碳酸氢钾,冷却,过滤,灼烧分解最终得到碳酸钾;
(1)由于霞石岩加石灰石和煤粉碎煅烧,煅烧需要很高的温度,所以煤的作用为:与氧气反应放热,达到煅烧的温度,故答案为:与氧气反应放热,达到煅烧的温度;
(2)溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO22后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)33
Al2O3+3H2O,故答案为:2Al(OH)3
Al2O3+3H2O.
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:CO2;CaSiO3;Na+、K+、HCO3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
△ △ △ △ Al22O33+3H22O,故答案为:2Al(OH)33
Al2O3+3H2O.
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:CO2;CaSiO3;Na+、K+、HCO3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
△ △ △ △ Al22O33+3H22O.
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO22气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na++、K++、HCO33--,故答案为:CO22;CaSiO33;Na++、K++、HCO33--;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO33溶液的pH约为8~9,Na22CO33溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO22--+CO22+3H22O=2Al(OH)33↓+CO332-2-.故答案为:2AlO22--+CO22+3H22O=2Al(OH)33↓+CO332-2-.
(6)由于NaHCO33溶液的pH约为8~9,Na22CO33溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO33结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO33结晶析出.
(1)由于霞石岩加石灰石和煤粉碎煅烧,煅烧需要很高的温度,所以煤的作用为:与氧气反应放热,达到煅烧的温度,故答案为:与氧气反应放热,达到煅烧的温度;
(2)溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO22后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)33
| ||
| ||
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:CO2;CaSiO3;Na+、K+、HCO3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.
| ||
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:CO2;CaSiO3;Na+、K+、HCO3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO22气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na++、K++、HCO33--,故答案为:CO22;CaSiO33;Na++、K++、HCO33--;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO33溶液的pH约为8~9,Na22CO33溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO22--+CO22+3H22O=2Al(OH)33↓+CO332-2-.故答案为:2AlO22--+CO22+3H22O=2Al(OH)33↓+CO332-2-.
(6)由于NaHCO33溶液的pH约为8~9,Na22CO33溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO33结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO33结晶析出.
看了 用霞石岩(化学式为KNa3[...的网友还看了以下:
求大神帮忙改下9年前的诗!流星碎雨,雨似泪.流星碎梦,梦难醒.流星碎情,情无终.流星碎缘,缘无份. 2020-05-17 …
已知多年平均流量,控制流域面积,多年平均流域面雨量,怎么求多年径流量,多年平均径流深,多年平均径. 2020-05-21 …
数据流图中的箭头线用以表示()。A.控制流B.数据流与控制流C.数据流D.数据来源 2020-05-24 …
● 计算以下控制流程图的环路复杂性 V(G),正确答案是(44) 。 (44)A.V(G)=2B.V 2020-05-26 …
液压系统中的液流阀的用途是( )。A.控制系统中液流的压力B.控制液体的流量C.控制液流的方向D.控 2020-06-07 …
十进制小数0.9转二进制0.9*2=1.81.8*2=1.60.6*2=1.20.2*2=0.40 2020-06-27 …
如图所示的电路中,有50只不同的电流表,50只规格相同的电压表.第一只电压表的读数为U1=9.6V 2020-07-17 …
请问怎样控制LED灯的电流?比如我用13.5V测试LED时他的电流我们规定要303左右的电流.但是 2020-07-19 …
读图,完成9~11题.指出图中流经辛庄和城区的河流基本流向()A.自东北流向西南B.自东南流向西北 2020-07-25 …
西汉的问题(8)/(9)★☆8.汉武帝曾?次派遣?出使?,联络各国对抗?,及后,西域各国开始派使节 2020-07-28 …