早教吧作业答案频道 -->化学-->
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.Ⅰ.氨气是一种重要的化工原料.(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)⇌(NH2)2CO(s
题目详情
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.
Ⅰ. 氨气是一种重要的化工原料.
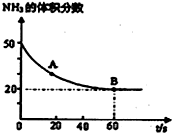
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:
CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:则A点的逆反应速率V(逆)(CO2)___B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是___.
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为___.该反应的化学平衡常数的表达式为___.
Ⅱ.氮的氧化物会污染环境.
(3)采取还原法,用炭粉可将氮的氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol-1,C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
写出炭粉还原一氧化氮的热化学反应方程式___
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为___.若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为___.
Ⅰ. 氨气是一种重要的化工原料.

(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:
CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:则A点的逆反应速率V(逆)(CO2)___B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是___.
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为___.该反应的化学平衡常数的表达式为___.
Ⅱ.氮的氧化物会污染环境.
(3)采取还原法,用炭粉可将氮的氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol-1,C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
写出炭粉还原一氧化氮的热化学反应方程式___
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为___.若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为___.
▼优质解答
答案和解析
(1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,即B点时v正(CO2)=v逆(CO2);
A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,则A点的逆反应速率小于B点的逆反应速率,所以A点的逆反应速率V(逆)(CO2)小于B点的正反应速率V(正)(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3⇌(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x
氨气的体积分数即物质的量分数=
=20%;
计算得到x=37.5mol
氨气的平衡转化率=
×100%=75%,
故答案为:<;75%;
(2)平均相对分子质量=
=
=26;化学平衡常数K=c(NH3)2c(CO2);故答案为:26;K=c(NH3)2c(CO2);
(3)已知:①N2(g)+O2(g)═2NO(g)△H=+180.6kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则②-①得到,C(s)+2NO(g)═CO2(g)+N2(g)△H=-393.5kJ•mol-1-180.6kJ•mol-1=-574.1kJ•mol-1,
故答案为:C(s)+2NO(g)═CO2(g)+N2(g)△H=-574.1kJ•mol-1;
(4)9.2gNO2的物质的量
=0.2mol,即0.2molNO2和Na2CO3溶液完全反应时转移电子0.1mol,则2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,若生成的CO2完全逸出,NO2-水解成碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
故答案为:2NO2+CO32-=NO3-+NO2-+CO2;c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,则A点的逆反应速率小于B点的逆反应速率,所以A点的逆反应速率V(逆)(CO2)小于B点的正反应速率V(正)(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3⇌(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x
氨气的体积分数即物质的量分数=
| 50-x |
| 100-x |
计算得到x=37.5mol
氨气的平衡转化率=
| 37.5mol |
| 50mol |
故答案为:<;75%;
(2)平均相对分子质量=
| m(总) |
| n(总) |
| 2×17+1×44 |
| 2+1 |
(3)已知:①N2(g)+O2(g)═2NO(g)△H=+180.6kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则②-①得到,C(s)+2NO(g)═CO2(g)+N2(g)△H=-393.5kJ•mol-1-180.6kJ•mol-1=-574.1kJ•mol-1,
故答案为:C(s)+2NO(g)═CO2(g)+N2(g)△H=-574.1kJ•mol-1;
(4)9.2gNO2的物质的量
| 9.2g |
| 46g/mol |
故答案为:2NO2+CO32-=NO3-+NO2-+CO2;c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
看了 氮的化合物是一把双刃剑,它既...的网友还看了以下:
合成氨工业是基础化学工业的重要组成部分.(1)以NH3与CO2为原料可合成化肥尿素.已知:①2NH 2020-07-17 …
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO( 2020-07-17 …
20世纪50年代开始,科学家受达尔文进化思想的启发,广泛开展了人工动、植物育种研究,通过人工创造变异 2020-12-01 …
氨可用于制取氨水、液氮、氮肥(尿素、碳铵等)、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、 2020-12-18 …
氨气作为一种重要的化工原料,主要用于生产氮肥、硝酸、纯碱、尿素等化工产品.下图是合成氨,并联合生产硝 2020-12-25 …
(2006•江苏)20世纪50年代,科学家受达尔文进化思想的启发,广泛开展了人工动、植物育种研究.通 2021-01-02 …
20世纪50年代,科学家受达尔文进化思想的启发,广泛开展了人工动植物育种研究,通过人工创造变异,选育 2021-01-02 …
20世纪50年代,科学家受达尔文进化思想的启发,广泛开展了人工动、植物育种研究.通过人工创造变异选育 2021-01-02 …
20世纪50年代,科学家受达尔文进化思想的启发,广泛开展了人工动植物育种研究,通过人工创造变异,选育 2021-01-02 …
20世纪50年代,科学家受达尔文进化思想的启发,广泛开展动植物育种研究,通过人工创造变异选育新品种, 2021-01-02 …