早教吧作业答案频道 -->化学-->
从结构的角度可以帮助我们更好的理解有机物的化学性质.(1)乙炔是一种重要的化工原料,将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.Cu+基态核外电子排布式为.乙炔与氢氰酸
题目详情
从结构的角度可以帮助我们更好的理解有机物的化学性质.

(1)乙炔是一种重要的化工原料,将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.Cu+基态核外电子排布式为___.乙炔与氢氰酸反应可得丙烯腈H2C=CH-C≡N.丙烯腈分子中碳原子轨道杂化类型是___.[Cu(NH3)2]Cl的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式___.
(2)实验室制乙炔使用的电石主要含有碳化钙,写出碳化钙的电子式___,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为___.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为___cm3
(3)甲醇催化氧化可得到甲醛,甲醛分子中的键角大约为___,甲醇的沸点比甲醛的高,其主要原因是___
(4)已知苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子为 判断相同温度下电离平衡常数Ka2(水杨酸)___Ka(苯酚)(填“>”或“<”),其原因是___.
判断相同温度下电离平衡常数Ka2(水杨酸)___Ka(苯酚)(填“>”或“<”),其原因是___.

(1)乙炔是一种重要的化工原料,将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.Cu+基态核外电子排布式为___.乙炔与氢氰酸反应可得丙烯腈H2C=CH-C≡N.丙烯腈分子中碳原子轨道杂化类型是___.[Cu(NH3)2]Cl的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式___.
(2)实验室制乙炔使用的电石主要含有碳化钙,写出碳化钙的电子式___,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为___.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为___cm3
(3)甲醇催化氧化可得到甲醛,甲醛分子中的键角大约为___,甲醇的沸点比甲醛的高,其主要原因是___
(4)已知苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子为
 判断相同温度下电离平衡常数Ka2(水杨酸)___Ka(苯酚)(填“>”或“<”),其原因是___.
判断相同温度下电离平衡常数Ka2(水杨酸)___Ka(苯酚)(填“>”或“<”),其原因是___.▼优质解答
答案和解析
(1)Cu为29号元素,Cu的基态原子的电子排布式为1s22s22p63s23p63d104s1,失去1个电子后生成Cu+,Cu+的基本电子排布式为1s22s22p63s23p63d10,H2C=CH-C≡N分子中连接双键的C原子价层电子对个数是3且不含孤电子对,所以为sp2杂化,连接三键的碳原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;[Cu(NH3)2]Cl的氨水溶液在空气中放置,+1价的铜迅速被氧气氧化,由无色变为深蓝色,反应为:4[Cu(NH3)2]++O2+8NH3∙H2O=4[Cu(NH3)4]2++6H2O+4OH- 或4[Cu(NH3)2]++O2+8NH3+2H2O=4[Cu(NH3)4]2++4OH-,
故答案为:1s22s22p63s23p63d10;sp、sp2;4[Cu(NH3)2]++O2+8NH3∙H2O=4[Cu(NH3)4]2++6H2O+4OH- 或4[Cu(NH3)2]++O2+8NH3+2H2O=4[Cu(NH3)4]2++4OH-;
(2)碳化钙属于离子化合物,阴离子中存在碳碳三键,碳化钙的电子式为: ,依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,CaC2晶体的晶胞结构与NaCl晶体的相似,该晶胞中含有Ca为12×
,依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,CaC2晶体的晶胞结构与NaCl晶体的相似,该晶胞中含有Ca为12×
+1=4,一个晶胞中含有4个CaC2,CaC2晶体的密度为2.22g/cm3,该晶胞的体积为V=
=
≈1.92×10-22cm3,
故答案为: ;4;1.92×10-22;
;4;1.92×10-22;
(3)甲醛(H2C=O)甲醛中C原子价层电子对个数=3+0=3,所以C原子的杂化方式为sp2杂化,C-H与C-H键夹角理论上是120度,但由于有羰基氧的孤对电子的排斥,实际键角应该略小于120度,所以甲醛分子中的键角大约为120度,氢键为分子间作用力,氢键影响物质的熔沸点,甲醇、甲醛均由分子构成,甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高,
故答案为:120度;甲醇有分子间氢键,甲醛没有分子间氢键;
(4)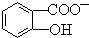 中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),
中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),
故答案为:<;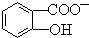 中-OH的氢原子形成分子内氢键,使其更难电离出H+.
中-OH的氢原子形成分子内氢键,使其更难电离出H+.
故答案为:1s22s22p63s23p63d10;sp、sp2;4[Cu(NH3)2]++O2+8NH3∙H2O=4[Cu(NH3)4]2++6H2O+4OH- 或4[Cu(NH3)2]++O2+8NH3+2H2O=4[Cu(NH3)4]2++4OH-;
(2)碳化钙属于离子化合物,阴离子中存在碳碳三键,碳化钙的电子式为:
 ,依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,CaC2晶体的晶胞结构与NaCl晶体的相似,该晶胞中含有Ca为12×
,依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,CaC2晶体的晶胞结构与NaCl晶体的相似,该晶胞中含有Ca为12×| 1 |
| 4 |
| m |
| ρ |
| 4×64 |
| 2.22×6.02×1023 |
故答案为:
 ;4;1.92×10-22;
;4;1.92×10-22;(3)甲醛(H2C=O)甲醛中C原子价层电子对个数=3+0=3,所以C原子的杂化方式为sp2杂化,C-H与C-H键夹角理论上是120度,但由于有羰基氧的孤对电子的排斥,实际键角应该略小于120度,所以甲醛分子中的键角大约为120度,氢键为分子间作用力,氢键影响物质的熔沸点,甲醇、甲醛均由分子构成,甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高,
故答案为:120度;甲醇有分子间氢键,甲醛没有分子间氢键;
(4)
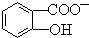 中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),
中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),故答案为:<;
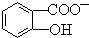 中-OH的氢原子形成分子内氢键,使其更难电离出H+.
中-OH的氢原子形成分子内氢键,使其更难电离出H+.
看了从结构的角度可以帮助我们更好的...的网友还看了以下:
向一定酸度0.1mol/lNiCl2溶液中通H2S气体至饱和〖C(H2S)=0.1mol/l〗,溶 2020-05-13 …
用10g溶质质量分数为20%的氢氧化钠溶液与20g硫酸铜溶液恰好完全反应 求硫酸铜溶质质量分数 , 2020-05-17 …
huaxue(1620:57:8)向一定质量的未知浓度的碌化钙溶液中,加入硝酸银溶液至完全沉淀为止 2020-05-20 …
某溶液中可能含有Na+、Ca2+、Br-、CO32-、I-、SO32-六种离子中的几种.①在该溶液 2020-07-02 …
在某溶液中滴加用硝酸化的BaCl2溶液有白色沉淀产生,该溶液中()A.一定含有SO42-B.一定含 2020-07-18 …
100g40%的氢氧化钠溶液恰好与200g硫酸溶液完全反应,生成硫酸钠和水,求:(1)生成硫酸钠多 2020-07-18 …
某中性含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中 2020-10-29 …
在量热计中将100ml0.5mol/L的ch3cooh溶液和100ml0.55mol/L的naoh溶 2020-11-13 …
下列实验现象描述正确的是()A.铜片放入硝酸银溶液中:紫红色固体表面有银白色固体产生,溶液由蓝色逐渐 2020-11-22 …
-------初中化学-----1.小明在一次实验中将带有铁锈的铁片放入稀硫酸中,现象:(1)铁锈逐 2020-11-24 …