早教吧作业答案频道 -->化学-->
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)⇌C8H8(g)+H2(g)△H>0Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质
题目详情
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)⇌C8H8(g)+H2(g)△H>0
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
(1)当反应进行到20min时,该段时间内H2的平均反应速率是___.
(2)该温度下,该反应的化学平衡常数是___.
(3)已知:
计算上述反应的△H=___ kJ•mol-1.若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是___.此时,该反应是否达到了平衡状态?___(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.
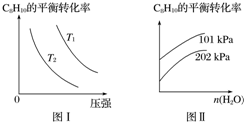
(4)由图Ⅰ可知,T1___T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将___(填“越大”、“越小”或“不变”),原因是___.
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是___.
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol‾1 | 412.5 | 348 | 612 | 436 |
计算上述反应的△H=___ kJ•mol-1.若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是___.此时,该反应是否达到了平衡状态?___(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.

(4)由图Ⅰ可知,T1___T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将___(填“越大”、“越小”或“不变”),原因是___.
▼优质解答
答案和解析
I.(1)将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.26mol,减少了0.14mol,
C8H10(g)⇌C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.14 0.14 0.14
20min(mol) 0.26 0.14 0.14
v(H2)=
=0.0035mol/(L•min)
故答案为:0.0035mol/(L•min);
(2)C8H10(g)⇌C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.08 0.08 0.08
30min(mol/L) 0.12 0.08 0.08
化学平衡常数K=
=
=0.053;
故答案为:0.053;
(3)C8H10(g)⇌C8H8(g)+H2(g),反应焓变△H=反应物键能总和-生成物键能总和=10×412.5+4×348+3×612-8×412.5-3×348-4×612-436=125KJ/mol,
根据C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,可知 C8H8(g)+H2(g)⇌C8H10(g)△H=-125kJ•mol-1,有30kJ热量放出时,消耗的H2量为0.24mol,所以氢气转化率=
×100%=
×100%=60%;
根据(2)知:平衡常数=0.053,则C8H8(g)+H2(g)⇌C8H10(g)的平衡常数为
=18.75,
C8H8(g)+H2(g)⇌C8H10(g)
起始(mol/L) 0.2 0.2 0
变化(mol/L) 0.12 0.12 0.12
某时刻(mol/L) 0.08 0.08 0.12
=
=18.75=18.75,反应达到平衡状态;
故答案为:125;60%;是;
Ⅱ.(4)C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;
故答案为:大于;
(5)其他条件不变,水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大;
故答案为:越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
C8H10(g)⇌C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.14 0.14 0.14
20min(mol) 0.26 0.14 0.14
v(H2)=
| ||
| 20min |
故答案为:0.0035mol/(L•min);
(2)C8H10(g)⇌C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.08 0.08 0.08
30min(mol/L) 0.12 0.08 0.08
化学平衡常数K=
| c(C8H8)c(H2) |
| c(C8H10) |
| 0.08×0.08 |
| 0.12 |
故答案为:0.053;
(3)C8H10(g)⇌C8H8(g)+H2(g),反应焓变△H=反应物键能总和-生成物键能总和=10×412.5+4×348+3×612-8×412.5-3×348-4×612-436=125KJ/mol,
根据C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,可知 C8H8(g)+H2(g)⇌C8H10(g)△H=-125kJ•mol-1,有30kJ热量放出时,消耗的H2量为0.24mol,所以氢气转化率=
| 消耗量 |
| 起始量 |
| 0.24mol |
| 0.4mol |
根据(2)知:平衡常数=0.053,则C8H8(g)+H2(g)⇌C8H10(g)的平衡常数为
| 1 |
| 0.053 |
C8H8(g)+H2(g)⇌C8H10(g)
起始(mol/L) 0.2 0.2 0
变化(mol/L) 0.12 0.12 0.12
某时刻(mol/L) 0.08 0.08 0.12
| c(C8H10) |
| c(C8H8)c(H2) |
| 0.12 |
| 0.08×0.08 |
故答案为:125;60%;是;
Ⅱ.(4)C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;
故答案为:大于;
(5)其他条件不变,水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大;
故答案为:越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
看了 苯乙烷(C8H10)可生产塑...的网友还看了以下:
1.下列化合物含有伯仲叔季氢原子的是()A.2244-四甲基戊烷 B.234-三甲基戊烷 C.22 2020-05-16 …
室内空气污染的主要来源之一是泡沫绝缘塑料、化纤地毯、书报、油漆等不同程度释放出的气体,该气体是() 2020-06-18 …
室内空气污染的主要来源之一是泡沫绝缘塑料、化纤地毯、书报、油漆等不同程度释放出的气体,该气体是() 2020-06-18 …
相同质量的下列烷烃完全燃烧时耗氧量最多的是()A.甲烷B.乙烷C.丙烷D.丁相同质量的下列烷烃完全 2020-06-25 …
下列卤化物在浓的KOH醇溶液中脱卤化氢的反应速度最快的是?选项为:a)1-溴戊烷b)2-溴戊烷c) 2020-06-28 …
2012年“3.15晚会”披露,市场上许多儿童玩具是用废旧塑料回收制得的,废旧塑料中会释放一种有毒 2020-07-10 …
农村常搭建横截面为半圆形的全封闭塑料薄膜蔬菜大棚.如果不考虑塑料薄膜埋在土里的部分,那么搭建一个这 2020-07-12 …
密闭容器中分别盛有以下各选项的物质,其中一定为纯净物的是()A.二氟甲烷B.二溴乙烷C.二甲基苯D 2020-07-22 …
简单的1道科学题在常温下使用到无气体放出时,钢瓶中常剩余一些液态物质,这些物质最有可能是()A.乙烷 2020-11-29 …
下列化合物沸点比较错误的是()A.丁烷>乙烷>甲烷B.1-氯戊烷<1-氯丙烷C.一氯乙烷>一氟乙烷D 2020-11-29 …