早教吧作业答案频道 -->化学-->
25℃时,三种酸的电离平衡常数如下:化学式CH3COOHH2CO3HClO电离平衡常数1.8×10-5K14.3×10-7K25.6×10-113.0×10-8回答下列问题:(1)一般情况下,当温
题目详情
25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”).
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号);
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(3)下列反应不能发生的是___(填序号)
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号);
a.
b.
c.
d.
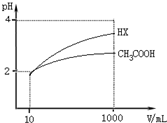
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示.
则HX的电离平衡常数___(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)___醋酸溶液中水电离出来的c(H+),理由是___;
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___ mol•L-1(填精确数值).
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |

(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”).
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号);
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(3)下列反应不能发生的是___(填序号)
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号);
a.
| c(CH3COOH) |
| c(H+) |
| c(CH3COO-) |
| c(CH3COOH) |
| c(H+) |
| kW |
| c(H+) |
| c(OH-) |
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示.
则HX的电离平衡常数___(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)___醋酸溶液中水电离出来的c(H+),理由是___;
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___ mol•L-1(填精确数值).
▼优质解答
答案和解析
(1)升高温度促进弱电解质的电离,所以当温度升高时,Ka增大;
故答案为:增大;
(2)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c,
故答案为:a>b>d>c;
(3)a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b.ClO-+CH3COOH═CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c.CO32-+HClO═CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d.2ClO-+CO2+H2O═CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
故答案为:c、d;
(4)a.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以
的比值减小,故a错误;
b.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则
的比值增大,故b正确;
c.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以
的比值减小,故c错误;
d.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,
的比值减小,故d错误;
故答案为:b;
(5)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,
根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+);溶液中氢离子浓度越小,对的抑制程度越小,水的电离程度越大,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱;
故答案为:大于;大于;稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱;
(6)pH=6,则c(H+)=10-6mol•L-1、c(OH-)=10-8mol•L-1,
溶液呈存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),
则:c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol•L-1-10-8mol•L-1=9.9×10-7mol•L-1,
故答案为:9.9×10-7.
故答案为:增大;
(2)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c,
故答案为:a>b>d>c;
(3)a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b.ClO-+CH3COOH═CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c.CO32-+HClO═CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d.2ClO-+CO2+H2O═CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
故答案为:c、d;
(4)a.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以
| c(CH3COOH) |
| c(H+) |
b.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则
| c(CH3COO-) |
| c(CH3COOH) |
c.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以
| c(H+) |
| kW |
d.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,
| c(H+) |
| c(OH-) |
故答案为:b;
(5)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,
根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+);溶液中氢离子浓度越小,对的抑制程度越小,水的电离程度越大,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱;
故答案为:大于;大于;稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱;
(6)pH=6,则c(H+)=10-6mol•L-1、c(OH-)=10-8mol•L-1,
溶液呈存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),
则:c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol•L-1-10-8mol•L-1=9.9×10-7mol•L-1,
故答案为:9.9×10-7.
看了 25℃时,三种酸的电离平衡常...的网友还看了以下:
关于ARM处理器的异常,以下说法错误的是()。A.复位异常级别最高B.FIQ是外部中断异常C.每个异 2020-05-23 …
由数据冗余引起的问题属于()。A.存储异常B.更新异常C.插入异常D.删除异常 2020-05-24 …
A.无冗余、无插入异常和删除异常B.无冗余,但存在插入异常和删除异常C.存在冗余,但不存在修改 2020-05-26 …
(36)A.3NF,无冗余、无插入异常和删除异常B.2NF,无冗余,但存在插入异常和删除异常C.2N 2020-05-26 …
静脉滴注0.9g每升的Nacl溶液,红细胞结果会?a,正常b,基本正常.c,静脉滴注0.9g每升的 2020-06-22 …
一对表现正常的夫妇,生了一个孩子既是红绿色盲又是klinefelter综合征(XXY型)患者,那么其 2020-11-25 …
数据库习题关系规范化中的操作异常是指()多选A、插入异常B、删除异常C、更新异常D、依赖异常关系规范 2020-12-01 …
结扎后的男性,他的生理状况可能是()A.不能产生精子,第二性征正常B.不能产生精子,第二性征不正常C 2020-12-07 …
静脉注射0.9/L的NaCl的溶液,红细胞的结果会()A.正常B.基本正常C.皱缩静脉注射0.9/L 2020-12-24 …
java声明异常还是抛出异常当方法产生该方法无法确定该如何处理的异常时,应该如何处理?A.声明异常B 2021-01-12 …